Perbezaan antara ikatan dπ-dπ dan ikatan delta
The Perbezaan utama antara ikatan dπ-dπ dan ikatan delta ialah bentuk ikatan dπ-dπ antara orbital atom d yang diisi dan orbital atom d kosong manakala ikatan delta membentuk antara empat lobus yang melibatkan orbital atom dan empat lobus yang lain melibatkan orbital atom.
Kedua-dua ikatan dπ-dπ dan bentuk ikatan delta melalui tumpang tindih orbital atom. Tumpahan orbital dalam pembentukan ikatan dπ-dπ mewujudkan ikatan koordinat manakala pembentukan ikatan delta yang bertindih membentuk ikatan kimia kovalen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah ikatan dπ-dπ
3. Apa itu Bond Delta
4. Perbandingan sampingan - ikatan Dπ -dπ vs delta dalam bentuk tabular
5. Ringkasan
Apakah ikatan dπ-dπ?
Ikatan dπ-dπ adalah sejenis ikatan kimia kovalen di mana logam mengikat dengan ligan melalui tumpang tindih orbital d mereka. Dalam erti kata lain, jenis ikatan kimia kovalen ini terbentuk apabila orbital d orbital logam peralihan menyumbangkan beberapa elektronnya kepada orbital d yang kosong ligan untuk membentuk ikatan kimia koordinasi. Oleh itu, sebatian kimia ini dinamakan sebagai kompleks koordinasi.
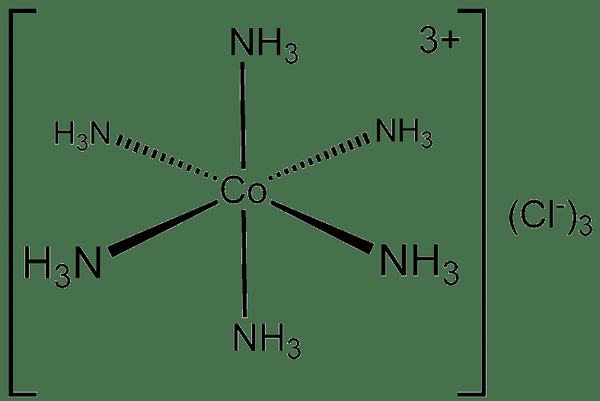
Rajah 01: Sebuah kompaun kovalen koordinat
Tidak seperti ikatan delta, yang menyerupai struktur ikatan dπ-dπ, ikatan dπ-dπ berlaku di antara orbital yang diisi dan orbital d kosong. Juga, ikatan delta boleh berlaku di antara mana-mana dua atom yang melibatkan orbital atom manakala ikatan dπ-dπ berlaku di antara logam peralihan yang telah menyelesaikan konfigurasi elektron D dan ligan yang mempunyai orbital kosong dalam doter elektron D.
Apa itu ikatan delta?
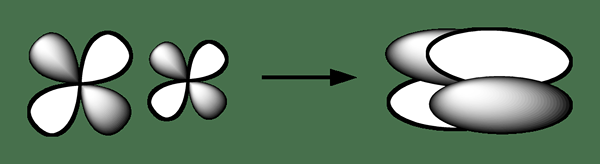
Ikatan delta adalah sejenis ikatan kimia di mana empat lobus yang melibatkan orbital atom cenderung bertindih dengan empat lobus yang lain yang melibatkan orbital atom untuk membentuk ikatan ini. Jenis tumpang tindih orbital ini membawa kepada pembentukan orbital molekul (ikatan) yang terdiri daripada dua pesawat nod yang mengandungi paksi internuclear, dan yang melalui kedua -dua atom. Surat Yunani untuk Tanda Delta "" digunakan untuk notasi ikatan delta.

Rajah 02: Pembentukan ikatan kimia delta
Umumnya, simetri orbital ikatan delta adalah serupa dengan jenis biasa orbit atom D apabila mempertimbangkan paksi ikatan. Kita dapat melihat jenis ikatan kimia ini dalam atom yang telah menduduki orbital atom D yang mengandungi tenaga yang rendah untuk mengambil bahagian dalam ikatan kimia kovalen. Sebagai contoh, logam peralihan yang berada dalam spesies kimia organometal menunjukkan ikatan delta; Sebatian kimia beberapa logam seperti rhenium, molibdenum, dan kromium mengandungi ikatan empat kali ganda. Ikatan empat kali terdiri daripada ikatan sigma, dua ikatan pi, dan ikatan delta.
Apabila mempertimbangkan simetri orbital ikatan delta, kita dapat melihat bahawa simetri adalah berbeza daripada orbital antibonding pi. Orbital antibonding Pi mengandungi satu satah nod yang terdiri daripada paksi internuclear dan satu lagi satah nodal yang berserenjang dengan paksi antara atom.
Saintis Robert Mulliken memperkenalkan notasi Delta pada tahun 1931. Dia mengenal pasti ikatan ini terlebih dahulu menggunakan potassium compound kimia octachlorodirhenate (III).
Apakah perbezaan antara ikatan dπ-dπ dan ikatan delta?
ikatan dπ-dπ dan delta adalah dua jenis ikatan kimia kovalen. Perbezaan utama antara ikatan dπ-dπ dan ikatan delta ialah bentuk ikatan dπ-dπ antara orbital atom d yang diisi dan orbital atom d kosong manakala ikatan delta membentuk antara empat lobus yang melibatkan orbital atom dan empat lobus yang lain melibatkan orbital atom yang terlibat.
Sebelum infographic meringkaskan perbezaan antara ikatan dπ-dπ dan ikatan delta dalam bentuk jadual.
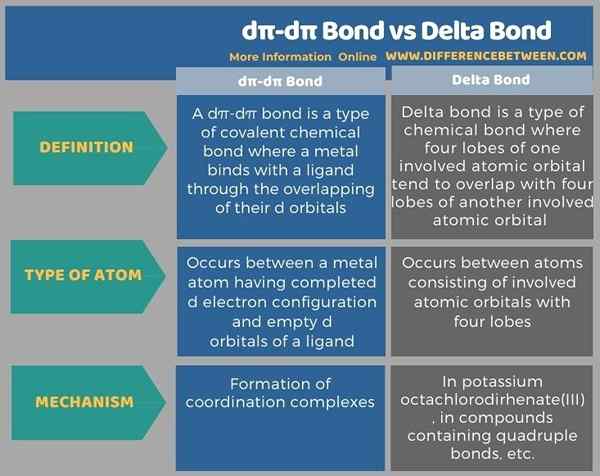
Ringkasan -ikatan Dπ -dπ vs ikatan delta
ikatan dπ-dπ dan ikatan delta adalah dua jenis ikatan kimia kovalen. Perbezaan utama antara ikatan dπ-dπ dan ikatan delta ialah bentuk ikatan dπ-dπ antara orbital atom d yang diisi dan orbital atom d kosong manakala ikatan delta membentuk antara empat lobus yang melibatkan orbital atom dan empat lobus yang lain melibatkan orbital atom yang terlibat.
Ihsan gambar:
1. "Coa6cl3" - Smokefoot Diasumsikan - Tiada sumber yang boleh dibaca mesin disediakan. Kerja sendiri diandaikan (berdasarkan tuntutan hak cipta). (Domain Awam) melalui Wikimedia Commons
2. "Delta-Bond-Formation-2d" oleh Ben Mills-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


