Perbezaan antara asid karboksilik dan alkohol

Asid karboksilik vs alkohol
Asid karboksilik dan alkohol adalah molekul organik dengan kumpulan fungsi kutub. Kedua -duanya mempunyai keupayaan untuk membuat ikatan hidrogen, yang mempengaruhi sifat fizikal mereka seperti titik mendidih.
Asid karboksilat
Asid karboksilik adalah sebatian organik yang mempunyai kumpulan berfungsi -COOH. Kumpulan ini dikenali sebagai kumpulan karboksil. Asid karboksilik mempunyai formula umum seperti berikut.
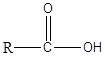
Dalam jenis asid carboxylic yang paling mudah, kumpulan r sama dengan h. Asid karboksilik ini dikenali sebagai asid formik. Selanjutnya, kumpulan r boleh menjadi rantai karbon lurus, rantai bercabang, kumpulan aromatik, dan lain -lain. Asid asetik, asid heksanoik, dan asid benzoik adalah beberapa contoh untuk asid karboksilat. Dalam tatanama IUPAC, asid karboksilik dinamakan dengan menjatuhkan final -e nama alkana yang sepadan dengan rantai terpanjang dalam asid dan dengan menambah -asid oik. Selalu, karbon karboksil diberikan nombor 1. Asid karboksilik adalah molekul kutub. Kerana kumpulan -OH, mereka boleh membentuk ikatan hidrogen yang kuat antara satu sama lain dan dengan air. Akibatnya, asid karboksilik mempunyai titik mendidih yang tinggi. Selanjutnya, asid karboksilik dengan berat molekul yang lebih rendah dengan mudah dibubarkan di dalam air. Walau bagaimanapun, apabila panjang rantai karbon meningkat, kelarutan berkurangan. Asid karboksilik mempunyai keasidan dari PKA 4-5. Oleh kerana mereka berasid, mereka bertindak balas dengan NaOH dan Nahco3 penyelesaian untuk membentuk garam natrium larut. Asid karboksilik seperti asid asetik adalah asid lemah, dan ia wujud dalam keseimbangan dengan asas konjugasi dalam media berair. Walau bagaimanapun, jika asid karboksilik mempunyai kumpulan mengeluarkan elektron seperti CL, F, mereka berasid daripada asid yang tidak diganti.
Alkohol
Ciri keluarga alkohol adalah kehadiran kumpulan berfungsi -OH (kumpulan hidroksil). Biasanya, kumpulan ini dipasang pada SP3 Karbon hibrid. Ahli keluarga yang paling mudah adalah metil alkohol, yang juga dikenali sebagai metanol. Alkohol boleh diklasifikasikan kepada tiga kumpulan sebagai primer, menengah dan tertiary. Klasifikasi ini berdasarkan tahap penggantian karbon yang mana kumpulan hidroksil dilampirkan secara langsung. Sekiranya karbon hanya mempunyai satu karbon lain yang melekat padanya, karbon dikatakan sebagai karbon utama dan alkohol adalah alkohol utama. Sekiranya karbon dengan kumpulan hidroksil dilampirkan pada dua karbon lain, maka itu adalah alkohol sekunder dan sebagainya. Alkohol dinamakan dengan akhiran -OL Menurut tatanama IUPAC. Pertama, rantai karbon berterusan terpanjang yang mana kumpulan hidroksil dilampirkan secara langsung harus dipilih. Kemudian nama alkana yang sepadan diubah dengan menjatuhkan final e dan menambah akhiran Ol.
Alkohol mempunyai titik mendidih yang lebih tinggi daripada hidrokarbon atau ether yang sepadan. Sebab ini adalah kehadiran interaksi intermolecular antara molekul alkohol melalui ikatan hidrogen. Sekiranya kumpulan R kecil, alkohol boleh dilarutkan dengan air, tetapi sebagai kumpulan r menjadi lebih besar, ia cenderung menjadi hidrofobik. Alkohol adalah kutub. Ikatan C-O dan O-H menyumbang kepada polariti molekul. Polarisasi ikatan O-H menjadikan hidrogen sebahagiannya positif dan menerangkan keasidan alkohol. Alkohol adalah asid lemah, dan keasidan adalah dekat dengan air. -Oh adalah kumpulan yang miskin, kerana oh- adalah asas yang kuat.
| Apakah perbezaan antara Asid karboksilik dan alkohol? • Kumpulan fungsi asid karboksilik adalah -cooh, dan dalam alkoholnya -OH. • Apabila kedua -dua kumpulan berada dalam satu molekul, keutamaan diberikan kepada asid karboksilik dalam tatanama. • Asid karboksilik mempunyai keasidan yang lebih tinggi berbanding dengan alkohol yang sepadan. • Kumpulan karboksil dan kumpulan -OH memberikan puncak ciri dalam spektrum IR dan NMR. |


