Perbezaan antara tenaga bon dan entalpi bon
Perbezaan utama - Entalpi Bond Vs Bond Vs
Kedua -dua tenaga bon dan entalpi ikatan menggambarkan konsep kimia yang sama; Jumlah tenaga yang diperlukan untuk memecahkan tahi lalat molekul ke dalam atom komponennya. Ini mengukur kekuatan ikatan kimia. Oleh itu ia juga dipanggil kekuatan ikatan. Tenaga bon dikira sebagai nilai purata tenaga pemisahan bon pada 298 K untuk spesies kimia dalam fasa gas. Tidak ada perbezaan yang besar antara istilah tenaga bon dan entalpi bon, tetapi Tenaga bon dilambangkan oleh "E" manakala entalpi bon dilambangkan oleh "H".
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Tenaga Bon
3. Apakah entalpi bon
4. Perbandingan sampingan - Entalpi Bond Vs Bond Vs dalam bentuk jadual
5. Ringkasan
Apa itu Tenaga Bon?
Entalpi tenaga atau ikatan bon adalah ukuran kekuatan bon. Tenaga bon adalah jumlah tenaga yang diperlukan untuk memecahkan tahi lalat molekul ke dalam atom komponennya. Ini bermaksud tenaga bon adalah tenaga yang diperlukan untuk memecahkan ikatan kimia. Tenaga bon dilambangkan sebagai "E". Unit pengukuran adalah kJ/mol.
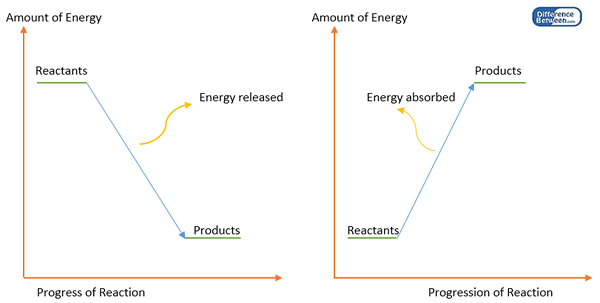
Ikatan kimia terbentuk di antara atom untuk mendapatkan keadaan yang stabil apabila atom individu mempunyai tenaga yang tinggi yang tidak stabil. Ini bermakna pembentukan ikatan kimia mengurangkan tenaga sistem. Oleh itu, beberapa tenaga dilepaskan (biasanya sebagai haba) ketika membentuk ikatan kimia. Oleh itu, pembentukan bon adalah reaksi eksotermik. Untuk memecahkan ikatan kimia ini, tenaga harus disediakan (jumlah tenaga yang sama dengan tenaga yang dikeluarkan semasa membentuk ikatan). Jumlah tenaga ini dikenali sebagai tenaga bon atau entalpi bon.

Rajah 1: Rajah tenaga untuk pembentukan bon (kiri) dan pemisahan bon (kanan).
Tenaga bon adalah sama dengan perbezaan antara entalpi produk (atom) dan reaktan (molekul permulaan). Setiap molekul harus mempunyai nilai tenaga bon sendiri. Tetapi ada pengecualian. Sebagai contoh, tenaga bon ikatan C-H bergantung kepada molekul di mana ikatan berlaku. Oleh itu, tenaga bon dikira sebagai nilai purata tenaga pemisahan bon.
Tenaga bon adalah purata tenaga pemisahan bon untuk spesies yang sama dalam fasa gas (pada suhu 298 K). Sebagai contoh, tenaga ikatan molekul metana (CH4) adalah jumlah tenaga yang diperlukan untuk membentuk atom karbon dan 4 radikal hidrogen. Kemudian tenaga ikatan ikatan C-H dapat dikira dengan mengambil jumlah tenaga pemisahan bon setiap bon C-H dan membahagikan jumlah nilai sebanyak 4.
Cth: Tenaga ikatan ikatan O-H dalam h2O molekul boleh dikira seperti berikut.
Jumlah tenaga yang diperlukan untuk memecahkan bon H-OH = 498.7 kJ/mol
Jumlah tenaga yang diperlukan untuk memecahkan ikatan O-H (dalam baki OH radikal) = 428 kJ/mol
Purata tenaga pemisahan bon = (498.7 + 428) / 2
= 463.35 kJ/mol ≈ 464 kJ/mol
Oleh itu, tenaga ikatan O-H dalam H2O molekul dianggap sebagai 464 kJ/mol.
Apakah entalpi bon?
Entalpi bon atau tenaga bon adalah jumlah tenaga yang diperlukan untuk memisahkan molekul ke dalam komponen atomnya. Ia adalah ukuran kekuatan ikatan. Entalpi bon dilambangkan sebagai "H".
Apakah perbezaan antara tenaga bon dan entalpi bon?
- Entalpi Tenaga atau Bond Bond adalah jumlah tenaga yang diperlukan untuk memecahkan mole molekul ke dalam atom komponennya.
- Tenaga bon dilambangkan sebagai "e" manakala entalpi bon dilambangkan sebagai "h".
Ringkasan -Tenaga Bon Vs Bond Enthalpy
Entalpi tenaga atau ikatan bon adalah jumlah tenaga yang diperlukan untuk memisahkan tahi lalat molekul ke dalam komponen atomnya dalam fasa gas. Ia dikira menggunakan nilai tenaga pemisahan bon ikatan kimia. Oleh itu tenaga bon adalah nilai purata tenaga pemisahan bon. Ia selalu menjadi nilai positif kerana pemisahan bon adalah endotermik (pembentukan bon adalah eksotermik). Tidak ada perbezaan yang besar antara tenaga bon dan entalpi bon.
Rujukan:
1. "Tenaga Bond."Kimia Libretexts, Libretexts, 20 Jan. 2017, boleh didapati di sini.
2. Helmenstine, Anne Marie. "Apa itu tenaga bon?"Thoughtco, boleh didapati di sini.
3. "Tenaga Bon."Wikipedia, Yayasan Wikimedia, 13 Mac. 2018, boleh didapati di sini.


