Perbezaan antara amphiprotik dan amphoterik
Amphiprotic vs amphoteric
Oleh kerana amphiprotik dan amphoterik agak serupa, perbezaan antara amphiprotik dan amphoterik juga agak mengelirukan. Kedua-dua istilah, amphiprotik dan amphoterik, kedua-duanya berkaitan dengan kimia asas asid. Bahan amphoterik berkelakuan sebagai asid dan sebagai asas. Semua bahan amphiprotik dapat menderma dan menerima proton dan dapat menunjukkan sifat asid dan asas. Oleh itu, mereka juga amphoterik. Artikel ini menerangkan perbezaan antara bahan amphiprotik dan bahan amphoterik secara terperinci. Selain itu, ia memberikan contoh dan reaksi untuk menunjukkan sifat mereka.
Apakah bahan amphiprotik?
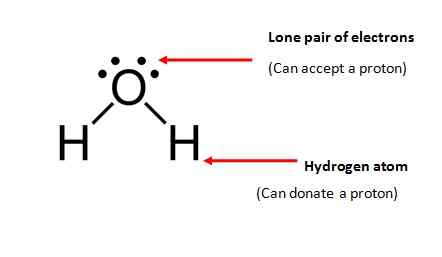
Istilah amphiprotik merujuk kepada bahan -bahan yang boleh menerima dan menderma proton; ia boleh sama ada ionik atau kovalen. Oleh itu, bahan amphoterik harus mempunyai dua sifat utama.
- Molekul mesti mengandungi sekurang -kurangnya satu atom hidrogen dan ia boleh disumbangkan kepada molekul lain.
- Molekul mesti mengandungi sepasang elektron tunggal (elektron yang tidak terlibat dalam ikatan kimia) untuk menerima proton.
Air (h2O) adalah bahan amphiprotik yang paling biasa; Molekul air memenuhi kedua -dua keperluan yang diperlukan untuk bahan amphiprotik.

Di samping air, kebanyakan asas asid diprotik konjugasi boleh bertindak sebagai bahan amphiprotik.
Pangkalan Konjugasi Asid Diprotik
H2Jadi4 Hso4-
H2Co3 HCO3-
H2S HS-
H2Cro3 Hcro3-
Contoh: Asid karbonik (h2Co3) adalah asid diprotik yang lemah, bikarbonat (HCO3-) adalah asas konjugasi. Dalam penyelesaian berair, bikarbonat menunjukkan dua jenis reaksi.
(1) Menyumbangkan proton ke air (sebagai asid bronsted - rendah)
HCO3- (aq) + H2O -> h3O+ (aq) + Co32- (aq)
(2) Menerima proton dari air (sebagai asas Bronsted - Lowry)
HCO3- (aq) + H2O -> h2Co3 (aq) + Oh- (aq)
Oleh itu, bikarbonat (HCO3-) adalah spesies amphiprotik.
Apakah bahan amphoterik?
Bahan yang boleh bertindak kerana kedua -dua asid dan asas dipanggil bahan amphoterik. Definisi ini agak serupa dengan bahan amphiprotik. Kerana, semua bahan amphiprotik menunjukkan sifat berasid dengan mendermakan proton dan juga, mereka menunjukkan sifat asas dengan menerima proton. Oleh itu, semua bahan amphiprotik boleh dianggap sebagai amphoterik. Walau bagaimanapun, pernyataan terbalik tidak selalu berlaku.
Kami mempunyai tiga teori untuk asid dan asas:
Asas asid teori
Arrhenius h+ pengeluar oh- penerbit
Bronsted-lowry h+ Donor h+ accepter
Lewis Electron Pair Penerim
Contoh: Al2O3 adalah asid Lewis dan pangkalan Lewis. Oleh itu, ia adalah bahan amphoterik, kerana ia tidak mengandungi proton (h+), ia bukan bahan amphiprotik.
Al2O3 sebagai pangkalan:
Al2O3 + 6 HCl-> 2 ALCL3 + 3 jam2O
Al2O3 Sebagai Asid:
Al2O3 + 2NAOH + 3 jam2O -> naal (oh)4
Apakah perbezaan antara amphiprotik dan amphoterik?
• Bahan amphiprotik bertindak sebagai asid dan sebagai asas. Bahan amphoterik boleh menerima atau menderma proton (h+ ion).
• Semua bahan amphoterik adalah amphiprotik, tetapi semua bahan amphiprotik bukan amphoterik.
• Spesies amphiprotik menganggap keupayaan untuk menderma atau menerima proton. Walau bagaimanapun, spesies amphoterik menganggap keupayaan untuk bertindak sebagai asid dan sebagai asas. Ciri-ciri asas asid bergantung kepada tiga faktor termasuk keupayaan untuk menderma atau menerima proton.
Sekiranya bahan mempunyai pasangan elektron untuk menderma dan ia mempunyai keupayaan untuk menerima pasangan elektron dianggap sebagai amphoterik.
Sekiranya bahan mempunyai keupayaan untuk menghasilkan kedua-dua ion H+ dan oh, ia dianggap sebagai amphoterik.
Ringkasan:
Amphiprotic vs amphoteric
Bahan amphoterik dan amphiprotik berkaitan dengan kimia asas asid. Kedua -dua bahan ini menunjukkan sifat asid dan asas. Dengan kata lain, mereka boleh bertindak balas sebagai asid dan sebagai asas bergantung kepada reaktan lain. Bahan amphiprotik boleh menderma dan menerima proton. Air adalah contoh yang paling biasa untuk spesies amphiprotik. Sebilangan besar asas asid diprotik yang konjugasi juga amphiprotik. Bahan amphoterik boleh berkelakuan sebagai asid dan sebagai asas.


