Perbezaan antara pengionan dan elektrolisis
The Perbezaan utama antara pengionan dan elektrolisis ialah Pengionan adalah pembentukan spesies kimia yang mempunyai cas elektrik, sedangkan elektrolisis adalah proses menggunakan arus elektrik untuk menjalankan tindak balas kimia bukan spontan.
Pengionan dan elektrolisis adalah proses yang sangat penting dalam kimia fizikal. Terdapat pelbagai cara untuk menjalankan proses pengionan. Elektrolisis juga boleh digunakan untuk mengionkan spesies kimia.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah pengionan
3. Apakah elektrolisis
4. Perbandingan sampingan -pengionan vs elektrolisis dalam bentuk jadual
5. Ringkasan
Apakah pengionan?
Pengionan adalah proses kimia di mana atom atau molekul mendapat caj positif atau negatif. Ia berlaku kerana sama ada mengeluarkan atau mendapatkan elektron dari atom atau molekul. Di sini, ion yang dihasilkan dinamakan sebagai kation atau anion, bergantung pada pertuduhan yang mereka ada, i.e. kation adalah ion dan anion positif yang dikenakan ion negatif. Pada asasnya, kehilangan elektron dari atom neutral atau molekul membentuk kation dan keuntungan elektron dari atom neutral memberikannya caj negatif, membentuk anion.
Apabila elektron dikeluarkan dari atom gas neutral dengan penambahan tenaga, ia membentuk kation monovalen. Ia adalah kerana atom neutral mempunyai bilangan elektron dan proton yang sama, menyebabkan tiada caj bersih; Apabila kita mengeluarkan elektron dari atom itu, terdapat satu proton berlebihan yang tidak mempunyai elektron untuk meneutralkan cajnya. Oleh itu, atom itu mendapat caj +1 (ia adalah caj proton). Jumlah tenaga yang diperlukan untuk ini adalah tenaga pengionan pertama atom itu.
Selain itu, pengionan yang berlaku dalam penyelesaian cecair adalah pembentukan ion dalam penyelesaian. Sebagai contoh, apabila molekul HCl larut dalam air, ion hidronium (h3O+) terbentuk. Di sini, HCL bertindak balas dengan molekul air dan bentuk ion hidronium yang dikenakan secara positif dan klorida yang dikenakan negatif (CL-) ion.
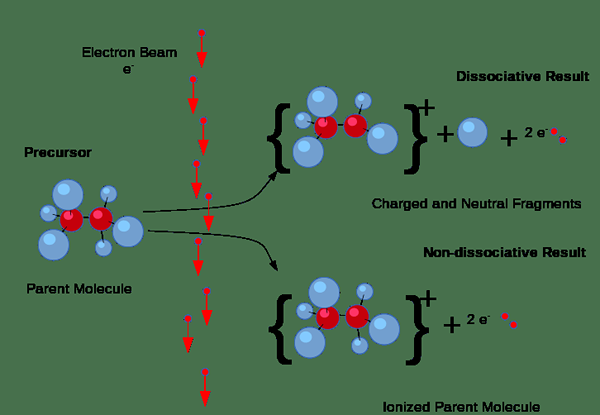
Tambahan pula, pengionan mungkin berlaku melalui perlanggaran. Tetapi, jenis pengionan ini berlaku terutamanya dalam gas apabila arus elektrik melalui gas. Sekiranya elektron dalam arus mempunyai jumlah tenaga yang mencukupi untuk mengeluarkan elektron dari molekul gas, mereka akan memaksa elektron dari molekul gas, menghasilkan pasangan ion yang terdiri daripada ion positif individu dan elektron negatif. Di sini, ion negatif juga terbentuk kerana sesetengah elektron cenderung melekat pada molekul gas dan bukannya menarik elektron keluar.
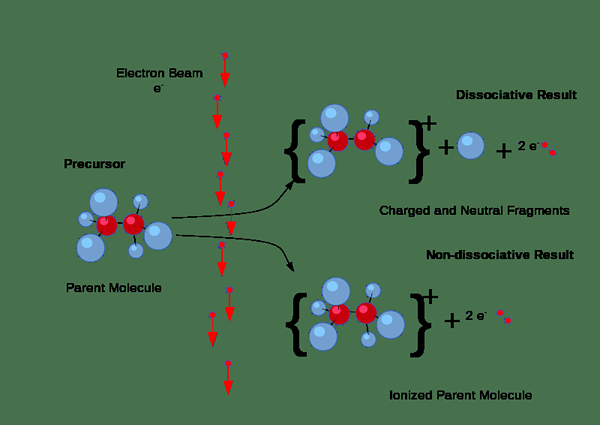
Rajah 01: Proses pengionan
Selain itu, pengionan berlaku apabila tenaga radiasi atau zarah -zarah yang dikenakan dengan cukup bertenaga melalui pepejal, cecair atau gas; Sebagai contoh, zarah alfa, zarah beta, dan radiasi gamma dapat mengionkan bahan; Oleh itu, kita namakan mereka sebagai radiasi pengionan.
Apakah elektrolisis?
Elektrolisis adalah proses menggunakan arus elektrik langsung untuk memacu reaksi kimia bukan spontan. Kita boleh melakukan ini menggunakan sel elektrolisis. Teknik elektrolisis penting untuk memisahkan sebatian ke dalam ion atau komponen lain.
Dalam elektrolisis, arus elektrik melewati penyelesaian untuk pergerakan ion dalam penyelesaian itu. Sel elektrolisis mengandungi dua elektrod yang direndam dalam penyelesaian yang sama. Dan, penyelesaian ini adalah elektrolit. Faktor penting dalam mengawal sel elektrolisis adalah "lebih berpotensi". Kita perlu memberikan voltan yang lebih tinggi untuk menjalankan tindak balas bukan spontan. Di sini, elektrod lengai juga boleh digunakan untuk menyediakan permukaan untuk reaksi yang berlaku.
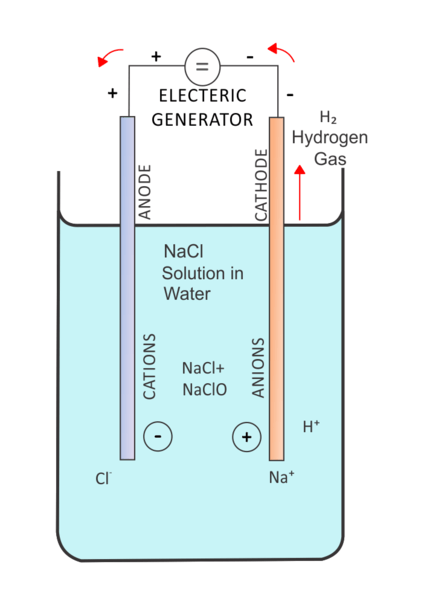
Rajah 02: Elektrolisis penyelesaian garam
Terdapat banyak aplikasi elektrolisis. Satu aplikasi biasa ialah elektrolisis air. Di sini, air adalah elektrolit. Kemudian tindak balas pecahan molekul air ke dalam hidrogen dan gas oksigen dilakukan menggunakan arus elektrik yang dilalui melalui elektrolit.
Apakah perbezaan antara pengionan dan elektrolisis?
Pengionan dan elektrolisis adalah proses yang sangat penting dalam kimia fizikal. Perbezaan utama antara pengionan dan elektrolisis ialah pengionan adalah pembentukan spesies kimia yang mempunyai cas elektrik, sedangkan elektrolisis adalah proses menggunakan arus elektrik untuk menjalankan tindak balas kimia bukan spontan.
Apabila mempertimbangkan proses, pengionan boleh berlaku kerana beberapa sebab seperti tindak balas antara spesies neutral dan ejen pengion, disebabkan oleh perlanggaran, disebabkan oleh radiasi pengion, dan lain -lain. Walau bagaimanapun, semua kaedah ini membawa kepada penyingkiran atau penambahan elektron kepada komponen kimia, i.e. Pembuangan elektron membentuk kation dan memperoleh satu elektron membentuk anion. Elektrolisis juga merupakan kaedah yang boleh kita gunakan untuk pengionan sebatian. Jadi, ini adalah perbezaan lain antara pengionan dan elektrolisis.

Ringkasan -Pengionan vs Elektrolisis
Pengionan dan elektrolisis adalah proses yang sangat penting dalam kimia fizikal. Perbezaan utama antara pengionan dan elektrolisis ialah pengionan adalah pembentukan spesies kimia yang mempunyai cas elektrik, sedangkan elektrolisis adalah proses menggunakan arus elektrik untuk menjalankan tindak balas kimia bukan spontan.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi elektrolisis dalam kimia."Thoughtco, Feb. 7, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Pengionan Elektron" oleh Evan Mason - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Elektrolisis Garam" oleh Sarah.Blumen - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


