Perbezaan antara asid dan asas
Perbezaan utama antara asid dan asas ialah Asid mempunyai nilai pH antara 1 hingga 7 manakala pangkalan mempunyai nilai pH antara 7 hingga 14.
Nilai pH adalah logaritma tolak H+ kepekatan ion. pH 7 dianggap sebagai pH neutral. Nilai pH lebih tinggi daripada 7 menunjukkan kehadiran asas manakala nilai di bawah 7 menunjukkan kehadiran asid. Menurut teori Brønsted-Lowry, asid dapat melepaskan H+ ion manakala pangkalan boleh menerima h+ ion.

Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Asid
3. Apa itu Pangkalan
4. Perbandingan sampingan - Asid vs asas dalam bentuk jadual
5. Ringkasan
Apa itu Asid?
Asid adalah bahan yang mempunyai pH kurang daripada 7 dalam larutan akueus mereka. Kehadiran medium berasid dapat ditentukan menggunakan kertas litmus. Asid boleh menjadikan litmus biru merah. Walau bagaimanapun, tidak ada perubahan warna jika litmus merah digunakan. Sebat.
Menurut teori Brønsted-Lowry, asid adalah bahan yang dapat melepaskan proton (h+ ion) ke medium ketika berada dalam medium berair. Bila h+ ion dibebaskan, ion -ion ini tidak boleh wujud sendiri dalam medium berair. Oleh itu ion -ion ini bergabung dengan molekul air, membentuk h3O+ ion (ion hidronium). Kehadiran ion hidronium, oleh itu, menunjukkan kehadiran asid.
Menurut teori Arrhenius, asid adalah bahan yang dapat meningkatkan jumlah ion hidronium dalam medium berair. Ini berlaku kerana peningkatan h+ ion. Dengan kata lain, asid melepaskan h+ ion, yang boleh berinteraksi dengan molekul air untuk membentuk ion hidronium.
Apabila mempertimbangkan teori Lewis, asid adalah sebatian yang dapat menerima sepasang elektron dari ikatan kimia kovalen. Berdasarkan definisi ini, bahan yang tidak mempunyai atom hidrogen juga dikategorikan sebagai asid kerana keupayaan mereka menerima pasangan elektron.
Sifat asid
Asid biasanya mempunyai rasa masam. PH asid selalu kurang dari 7. Hampir semua asid mempunyai bau yang terbakar. Tekstur asid melekit dan bukannya licin. Tambahan pula, asid boleh bertindak balas dengan logam (walaupun logam yang sangat tidak aktif) untuk membentuk gas hidrida logam dan hidrogen.
Apa itu Pangkalan?
Pangkalan adalah bahan yang menunjukkan nilai pH lebih tinggi daripada 7 apabila ia berada dalam larutan akueus. Asas penyelesaian menyebabkan warna litmus merah menjadi warna biru. Oleh itu, kehadiran asas dapat ditentukan menggunakan litmus merah. Walau bagaimanapun, apabila litmus biru digunakan, tiada perubahan warna dengan asas. Sebat.
Menurut teori Brønsted-Lowry, pangkalan adalah penerima proton; Dengan kata lain, pangkalan boleh menerima proton dari medium berair. Walau bagaimanapun, teori Arrhenius juga memberikan definisi yang sama: asas adalah bahan yang mengurangkan jumlah ion hidronium yang terdapat dalam medium. Kepekatan ion hidronium berkurangan kerana asas memperoleh h+ ion atau proton dari medium berair. Ion ini diperlukan untuk pembentukan ion hidronium.

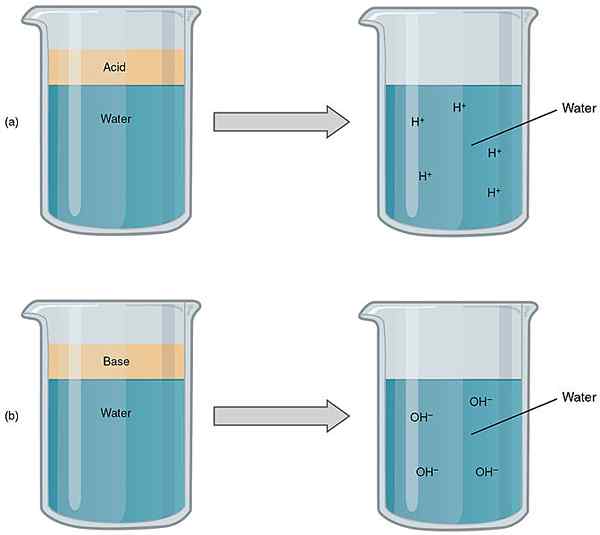
Rajah 1: Perbandingan asid dan pangkalan
Semasa mempertimbangkan teori Lewis, asas adalah bahan yang boleh mendermakan pasangan elektron. Bahan ini mendermakan pasangan elektron dan membentuk ikatan kovalen koordinat. Menurut teori ini, kebanyakan sebatian yang tidak mempunyai kumpulan OH.
Sifat asas
Pangkalan mempunyai rasa pahit. Bahan -bahan ini selalu menunjukkan nilai pH lebih tinggi daripada 7. Hampir semua pangkalan tidak berbau, kecuali ammonia. Ammonia mempunyai bau pedas. Tidak seperti asid, pangkalan berasa licin. Pangkalan dapat dinetralkan apabila bertindak balas dengan asid.
Apakah perbezaan antara asid dan asas?
Asid vs asas | |
| Asid adalah bahan yang menunjukkan nilai pH lebih rendah daripada 7 apabila ia berada dalam larutan berair | Pangkalan adalah bahan yang menunjukkan nilai pH lebih tinggi daripada 7 apabila ia berada dalam larutan akueus |
| Definisi Berdasarkan Teori Brønsted-Lowry | |
| Asid adalah bahan yang dapat melepaskan proton (h+ ion) ke medium apabila ia berada dalam medium berair. | Pangkalan adalah penerima proton; Dengan kata lain, pangkalan boleh menerima proton dari medium berair. |
| Definisi berdasarkan teori Arrhenius | |
| Asid adalah bahan yang dapat meningkatkan jumlah ion hidronium dalam medium berair. | Pangkalan adalah bahan yang dapat mengurangkan jumlah ion hidronium dalam medium berair. |
| Definisi berdasarkan teori Lewis | |
| Asid adalah sebatian yang dapat menerima sepasang elektron dari ikatan kimia kovalen. | Pangkalan adalah bahan yang boleh mendermakan pasangan elektron. |
| Perubahan warna dalam litmus | |
| Asid boleh menjadikan merah litmus biru, tetapi tidak ada perubahan warna dalam litmus merah. | Pangkalan boleh bertukar menjadi litmus merah, tetapi tidak ada perubahan warna dalam litmus biru. |
| Rasa | |
| AIDS mempunyai rasa masam. | Pangkalan mempunyai rasa pahit. |
| Bau | |
| Asid mempunyai bau yang terbakar. | Pangkalan tidak berbau, kecuali ammonia. |
| Pengionan | |
| Asid boleh membentuk ion hidronium apabila terionisasi. | Pangkalan boleh membentuk ion hidroksil apabila terionisasi. |
| Spesies Kimia Konjugasi | |
| Spesies konjugasi asid adalah asas konjugasi. | Spesies conjugate asas adalah asid konjugatnya. |
| Peneutralan | |
| Asid boleh dinetralkan menggunakan asas. | Asas boleh dinetralkan menggunakan asid. |
| Titrasi | |
| Asid dititrasi dengan asas untuk peneutralan. | Pangkalan bertindak balas dengan asid untuk peneutralan. |
Ringkasan - Asid vs Pangkalan
Semua sebatian boleh dikategorikan ke dalam asid, pangkalan dan sebatian neutral. Perbezaan utama antara asid dan asas ialah asid mempunyai nilai pH antara 1 hingga 7 manakala pangkalan mempunyai nilai pH antara 7 hingga 14.
Rujukan:
1. Helmenstine, Anne Marie. "Inilah asid dalam kimia."Thoughtco, boleh didapati di sini.
2. Helmenstine, Anne Marie. "Asid utama dan definisi asas."Thoughtco, boleh didapati di sini.
3. Libretexts. "Gambaran keseluruhan asid dan pangkalan."Kimia Libretexts, Libretexts, 13 Feb. 2017, boleh didapati di sini.
Ihsan gambar:
1. "215 Asid dan Pangkalan -01" oleh OpenStax College - Anatomi & Fisiologi, Laman Web Connexions, 19 Jun 2013 (CC oleh 3.0) melalui Commons Wikimedia


