Apakah perbezaan antara keseimbangan ionik dan keseimbangan kimia
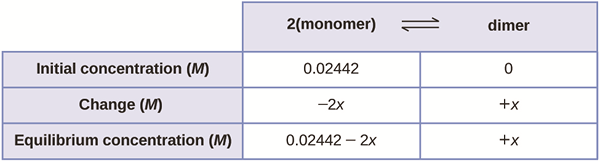
The Perbezaan utama antara keseimbangan ionik dan keseimbangan kimia Adakah keseimbangan ionik berlaku antara molekul dan ion bersatu dalam elektrolit, sedangkan keseimbangan kimia berlaku antara reaktan kimia dan produk.
Keseimbangan ionik dan kimia adalah fenomena penting dalam kimia. Keseimbangan ionik adalah keseimbangan yang ditubuhkan antara molekul bersatu dan ion dalam larutan elektrolit yang lemah. Keseimbangan kimia adalah keadaan di mana kedua -dua reaktan dan produk hadir dalam kepekatan yang tidak mempunyai kecenderungan selanjutnya untuk berubah dengan masa.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah keseimbangan ionik
3. Apakah keseimbangan kimia
4. Keseimbangan ionik vs keseimbangan kimia dalam bentuk jadual
5. Ringkasan - Keseimbangan Ionik vs Keseimbangan Kimia
Apakah keseimbangan ionik?
Keseimbangan ionik dapat digambarkan sebagai keseimbangan yang ditubuhkan antara molekul bersatu dan ion dalam larutan elektrolit yang lemah. Umumnya, pH mengukur keasidan atau kealkalian penyelesaian. Ini kerana asid cenderung melepaskan ion hidrogen ke dalam larutan. Sekiranya garam larut larut dibubarkan di dalam air, keseimbangan ionik dibuat.
Keseimbangan ionik juga merupakan jenis keseimbangan di mana jumlah produk dan reaktan tidak berubah dari masa ke masa. Walau bagaimanapun, ini tidak bermakna bahawa tindak balas telah berhenti; Sebaliknya, reaksi sedang berjalan dengan cara yang menjadikan jumlah tidak berubah (perubahan bersih adalah sifar).
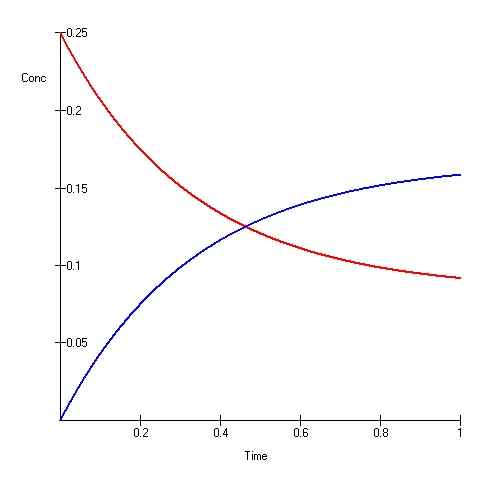
Keseimbangan ionik juga dikenali sebagai "keseimbangan dinamik."Dalam jenis keseimbangan ini, tindak balasnya boleh diterbalikkan dan berterusan. Untuk keseimbangan dinamik berlaku, sistem harus ditutup sehingga tidak ada tenaga atau bahan yang melarikan diri dari sistem.
Apakah keseimbangan kimia?
Keseimbangan kimia dapat digambarkan sebagai keadaan di mana kedua -dua reaktan dan produk hadir dalam kepekatan yang tidak mempunyai kecenderungan untuk berubah dengan masa. Beberapa tindak balas boleh diterbalikkan, dan beberapa tindak balas tidak dapat dipulihkan. Dalam tindak balas, reaktan menukar kepada produk. Dalam beberapa tindak balas, reaktan dihasilkan semula dari produk. Oleh itu, tindak balas jenis ini boleh diterbalikkan.
Dalam tindak balas yang tidak dapat dipulihkan, apabila reaktan ditukar kepada produk, mereka tidak akan menjana semula dari produk. Dalam tindak balas yang boleh diterbalikkan, apabila reaktan akan pergi ke produk, kami menyebutnya reaksi ke hadapan, dan ketika produk akan menjadi reaktan, itu adalah reaksi mundur.

Apabila kadar tindak balas ke hadapan dan mundur adalah sama, maka tindak balas adalah pada keseimbangan. Oleh itu, dalam beberapa waktu, jumlah reaktan dan produk tidak berubah. Reaksi yang boleh diterbalikkan selalu cenderung untuk datang ke keseimbangan dan mengekalkan keseimbangan itu. Apabila sistem berada dalam keseimbangan, jumlah produk dan reaktan tidak semestinya sama. Terdapat jumlah reaktan yang lebih tinggi daripada produk atau sebaliknya. Satu -satunya keperluan dalam persamaan keseimbangan ialah penyelenggaraan jumlah yang berterusan dari kedua -dua masa. Untuk tindak balas dalam keseimbangan, kita dapat menentukan pemalar keseimbangan sebagai: di mana ia sama dengan nisbah antara kepekatan produk dan kepekatan reaksi.
Untuk tindak balas keseimbangan, jika tindak balas ke hadapan adalah eksotermik, maka tindak balas mundur adalah endotermik dan sebaliknya. Biasanya, semua parameter lain untuk reaksi ke hadapan dan mundur bertentangan antara satu sama lain seperti ini. Oleh itu, jika kita mahu memudahkan salah satu tindak balas, kita hanya perlu menyesuaikan parameter untuk memudahkan reaksi itu.
Apakah perbezaan antara keseimbangan ionik dan keseimbangan kimia?
Keseimbangan ionik dan kimia adalah fenomena penting dalam kimia. Perbezaan utama antara keseimbangan ionik dan keseimbangan kimia ialah keseimbangan ionik berlaku antara molekul dan ion bersatu dalam elektrolit, manakala keseimbangan kimia berlaku antara reaktan kimia dan produk.
Infographic di bawah membentangkan perbezaan antara keseimbangan ionik dan keseimbangan kimia dalam bentuk tabular untuk perbandingan sampingan.
Ringkasan -Keseimbangan Ionik vs Keseimbangan Kimia
Keseimbangan ionik adalah keseimbangan yang ditubuhkan antara molekul bersatu dan ion dalam larutan elektrolit yang lemah. Keseimbangan kimia adalah keadaan di mana kedua -dua reaktan dan produk hadir dalam kepekatan yang tidak mempunyai kecenderungan selanjutnya untuk berubah dengan masa. Perbezaan utama antara keseimbangan ionik dan keseimbangan kimia ialah keseimbangan ionik berlaku antara molekul dan ion bersatu dalam elektrolit, manakala keseimbangan kimia berlaku antara reaktan kimia dan produk.
Rujukan:
1. "Pengenalan, jenis dan fungsi keseimbangan ionik." Kullabs.
Ihsan gambar:
1. "CNX CHEM 13 04 ICETABLE25 IMG" oleh OpenStax - (CC oleh 4.0) melalui Commons Wikimedia
2. "Keseimbangan Kimia" oleh V8rik di Wikipedia Bahasa Inggeris (CC BY-SA 3.0) melalui Commons Wikimedia


