Apakah perbezaan antara homolisis dan heterolisis
The Perbezaan utama antara homolisis dan heterolisis Adakah homolisis adalah pecahan sebatian kimia ke dalam dua bahagian yang sama kimia, sedangkan heterolisis adalah pecahan sebatian kimia ke dalam dua bahagian kimia yang berbeza.
Kita boleh menggunakan tenaga pemisahan bon sebatian kimia untuk menggambarkan proses homolisis dan heterolisis. Tenaga pemisahan bon adalah ukuran kekuatan ikatan kimia. Ikatan boleh dipisahkan dengan cara homolitik atau cara heterolitik. Tenaga pemisahan bon ditakrifkan sebagai perubahan entalpi standard apabila ikatan kimia dipotong melalui homolisis.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu homolisis
3. Apakah heterolisis
5. Homolisis vs heterolisis dalam bentuk jadual
6. Ringkasan
Apa itu homolisis?
Homolisis adalah belahan ikatan kimia dengan cara yang memberikan dua bahagian kimia yang sama dari sebatian kimia. Ikatan kimia (ikatan kovalen) mengandungi dua elektron. Dalam bentuk pembelahan ini, setiap serpihan mendapat satu elektron yang tidak berpasangan. Apabila pemisahan ikatan ini berlaku dalam molekul neutral yang mempunyai bilangan elektron yang sama, ia membentuk dua radikal bebas yang sama.

Rajah 01: Mekanisme pembelahan homolitik umum
Tenaga pemisahan ikatan homolitik adalah jumlah tenaga yang diperlukan untuk memisahkan ikatan kimia melalui hemolisis. Hemolisis ikatan kimia adalah pembelahan simetri dari dua radikal yang membentuk ikatan, bukan dua ion. Di sini, elektron ikatan antara atom dibahagikan kepada dua bahagian dan diambil oleh kedua -dua atom. Contohnya, belahan homolitik ikatan sigma membentuk dua radikal yang mempunyai satu elektron yang tidak berpasangan setiap radikal.
Apakah heterolisis?
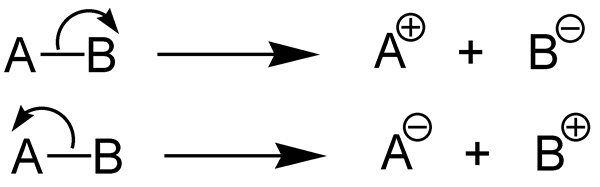
Heterolysis adalah belahan ikatan kimia dengan cara yang memberikan dua bahagian kimia yang berbeza dari sebatian kimia. Pembelahan heterolitik adalah pemisahan ikatan kimia dan membentuk dua serpihan yang tidak sama rata. Ikatan kimia (ikatan kovalen) mengandungi dua elektron. Dalam bentuk pembelahan ini, satu serpihan mendapat kedua -dua pasangan elektron bon manakala serpihan lain tidak mendapat elektron ikatan.

Rajah 02: Dua jenis fisi heterolitik
Tenaga pemisahan ikatan heterolitik adalah jumlah tenaga yang diperlukan untuk mencengkam ikatan kimia melalui heterolisis. Heterolisis adalah belahan ikatan kimia dengan cara yang tidak simetris. Heterolysis membentuk kation dan anion sejak, dalam heterolisis, pasangan elektron ikatan diambil oleh atom elektronegatif (ia ditukar menjadi anion), sementara atom lain tidak mengambil elektron (ia membentuk kation).
Apakah perbezaan antara homolisis dan heterolisis?
Homolisis dan heterolisis adalah proses kimia yang bertentangan antara satu sama lain. Perbezaan utama antara homolisis dan heterolisis ialah homolisis adalah pecahan sebatian kimia ke dalam dua bahagian yang sama kimia, sedangkan heterolisis adalah pecahan sebatian kimia ke dalam dua bahagian kimia yang berbeza. Selain itu, tenaga pemisahan ikatan homolitik menentukan tenaga yang diperlukan untuk homolisis berlaku manakala tenaga pemisahan ikatan heterolitik menentukan tenaga yang diperlukan untuk heterolisis berlaku.
Infographic berikut meringkaskan perbezaan antara homolisis dan heterolisis dalam bentuk tabular.
Ringkasan -Homolisis vs heterolisis
Homolisis dan heterolisis adalah proses kimia yang bertentangan antara satu sama lain. Perbezaan utama antara homolisis dan heterolisis ialah homolisis adalah pecahan sebatian kimia ke dalam dua bahagian yang sama kimia, sedangkan heterolisis adalah pecahan sebatian kimia ke dalam dua bahagian kimia yang berbeza.
Rujukan:
1."Homolisis." Gambaran Keseluruhan | Topik Sciencedirect.
Ihsan gambar:
1. "Homolisis (Kimia)" oleh Jürgen Martens - Jürgen Martens (Domain Awam) melalui Commons Wikimedia
2. "Heterolisis (Kimia)" oleh Jürgen Martens - Jürgen Martens (CC By -SA 3.0) melalui Commons Wikimedia


