Apakah perbezaan antara haba penyelesaian dan haba tindak balas
The Perbezaan utama antara haba penyelesaian dan haba tindak balas adalah bahawa haba larutan adalah jumlah tenaga haba yang dikeluarkan atau diserap oleh sistem kimia apabila pembentukan penyelesaian, sedangkan haba reaksi adalah perbezaan antara jumlah reaktan dan jumlah entalpi molar produk yang dikira untuk bahan kimia dalam keadaan standard.
Haba penyelesaian dan haba tindak balas adalah nilai entalpi penting dalam kimia fizikal yang berguna dalam penentuan sifat penyelesaian dan tindak balas kimia.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu haba penyelesaian
3. Apa itu haba reaksi
4. Haba larutan vs haba reaksi dalam bentuk jadual
5. Ringkasan -Panas penyelesaian vs haba reaksi
Apa itu haba penyelesaian?
Haba penyelesaian atau entalpi penyelesaian adalah jumlah tenaga haba yang dikeluarkan atau diserap oleh sistem kimia apabila pembentukan penyelesaian. Nilai entalpi ini berkaitan dengan pembubaran bahan dalam pelarut yang berada dalam tekanan yang berterusan, yang mengakibatkan pencairan tak terhingga.
Selalunya, haba penyelesaian diberikan untuk suhu malar dalam kJ/mol. Terdapat tiga bahagian perubahan tenaga ini: memecah endotermik ikatan kimia yang wujud dalam pelarut, memecahkan ikatan kimia dalam larut, dan pembentukan daya tarikan antara larutan dan pelarut. Lebih-lebih lagi, kita boleh mengatakan bahawa penyelesaian yang ideal biasanya mengandungi entalpi pencampuran null sementara larutan bukan ideal mempunyai kuantiti molar yang berlebihan.
Apabila mempertimbangkan kebanyakan gas, pembubaran adalah eksotermik. Apabila gas dibubarkan dalam cecair, tenaga dilepaskan sebagai haba dengan memanaskan kedua -dua penyelesaian dan persekitaran. Suhu penyelesaian cenderung menurun akhirnya, sepadan dengan suhu sekitarnya. Selanjutnya, jika kita memanaskan penyelesaian tepu gas, gas cenderung keluar dari penyelesaian.
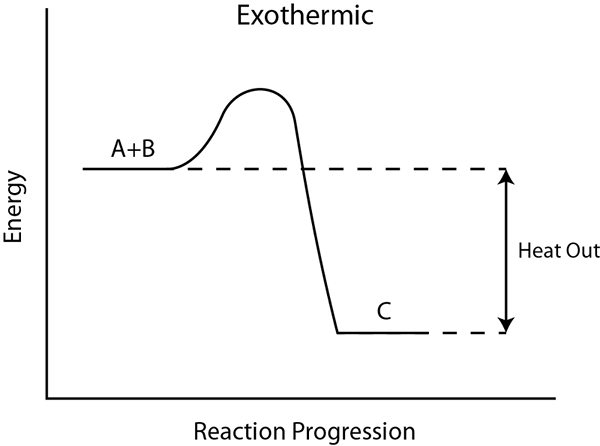
Apa itu haba reaksi?
Haba reaksi atau reaksi entalpi adalah perbezaan antara jumlah reaktan dan jumlah produk molar yang dikira untuk bahan kimia dalam keadaan standard. Nilai entalpi ini berguna dalam meramalkan jumlah tenaga ikatan kimia yang dilepaskan atau terikat semasa tindak balas kimia. Di sini, kita perlu mengambil kira entalpi pencampuran juga.
Dalam penentuan haba tindak balas, keadaan standard boleh ditakrifkan untuk sebarang suhu dan nilai tekanan, dan nilai mesti ditentukan untuk suhu dan tekanan tertentu, tetapi nilai -nilai biasanya diberikan pada suhu darjah 25 Celsius dan tekanan 1 atm.

Apabila mempertimbangkan ion dalam larutan berair, kita boleh memilih keadaan standard, memandangkan kepekatan ion h+ akueus tepat 1 mol/L mempunyai entalpi standard sifar pembentukan. Ini memungkinkan untuk menetapkan enthalpi standard untuk kation dan anion pada kepekatan standard yang sama.
Apakah perbezaan antara haba penyelesaian dan haba tindak balas?
Haba penyelesaian dan haba tindak balas adalah nilai entalpi penting dalam kimia fizikal yang berguna dalam penentuan sifat penyelesaian dan tindak balas kimia. Perbezaan utama antara haba larutan dan haba tindak balas ialah haba larutan adalah jumlah tenaga haba yang dikeluarkan atau diserap oleh sistem kimia apabila pembentukan penyelesaian, sedangkan haba reaksi adalah perbezaan antara jumlah reaktan dan jumlah produk molar produk yang dikira untuk bahan kimia dalam keadaan standard.
Infographic di bawah menyenaraikan perbezaan antara haba larutan dan haba tindak balas dalam bentuk tabular untuk perbandingan sampingan.
Ringkasan -Panas penyelesaian vs haba reaksi
Haba penyelesaian dan haba tindak balas adalah nilai entalpi penting dalam kimia fizikal yang berguna dalam penentuan sifat penyelesaian dan tindak balas kimia. Perbezaan utama antara haba larutan dan haba tindak balas ialah haba larutan adalah jumlah tenaga haba yang dikeluarkan atau diserap oleh sistem kimia apabila pembentukan penyelesaian, sedangkan haba reaksi adalah perbezaan antara jumlah reaktan dan jumlah produk molar produk yang dikira untuk bahan kimia dalam keadaan standard.
Rujukan:
1. "Haba formula reaksi - Definisi, Persamaan dan Contoh yang diselesaikan."Byju, 15 Sept. 2020.
Ihsan gambar:
1. "Reaksi Exothermic" oleh Brazosport College - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


