Apakah perbezaan antara elektrolit dan elektrolisis
The Perbezaan utama antara elektrolit dan elektrolisis adalah bahawa elektrolit adalah bahan yang dapat menghasilkan ion, sedangkan elektrolisis adalah proses di mana arus elektrik digunakan untuk memacu reaksi kimia.
Kami terutamanya menggunakan istilah elektrolit dan elektrolisis dalam elektrokimia, di mana kami menyiasat hubungan antara elektrik dan kimia.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu elektrolit
3. Apa itu elektrolisis
4. Elektrolit vs elektrolisis dalam bentuk jadual
5. Ringkasan - Elektrolis elektrolis
Apa itu elektrolit?
Elektrolit adalah bahan yang dapat menghasilkan ion. Elektrolit menyediakan ion ketika berada di peringkat cair atau ketika mereka dibubarkan dalam pelarut (air). Ion ini menjadikan elektrolit dapat menjalankan elektrik. Walau bagaimanapun, terdapat beberapa elektrolit keadaan pepejal juga. Tambahan pula, beberapa gas seperti karbon dioksida menghasilkan ion (hidrogen dan ion bikarbonat) ketika mereka larut dalam air.
Kita boleh mengkategorikan elektrolit ke dalam dua kumpulan yang berbeza: elektrolit yang kuat dan elektrolit yang lemah. Antaranya, elektrolit yang kuat dengan mudah menghasilkan ion apabila mereka larut. Sebagai contoh, sebatian ionik adalah elektrolit yang kuat. Sodium klorida atau penyelesaian NaCl berair menjalani pemisahan lengkap (ke Na+ dan Cl-ion); Oleh itu, mereka adalah konduktor elektrik yang baik. Asid dan asas yang kuat juga elektrolit yang baik. Sebaliknya, elektrolit yang lemah menghasilkan beberapa ion apabila mereka larut dalam air. Selain itu, asid lemah seperti asid asetik dan asas lemah adalah elektrolit yang lemah.

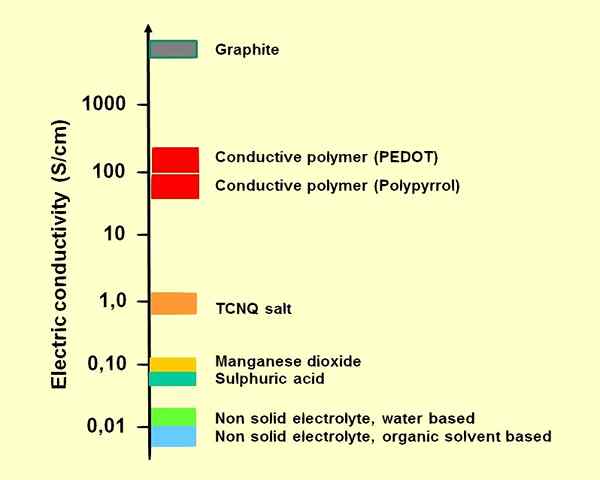
Rajah 01: Kondisi beberapa elektrolit untuk kapasitor elektrolitik
Elektrolit juga berlaku di dalam badan. Kami memerlukan elektrolit ini untuk mengekalkan keseimbangan ionik di dalam sel dan cecair darah dalam badan yang sihat. Keseimbangan elektrolit sangat penting untuk mengekalkan keseimbangan osmotik dan tekanan darah di dalam badan. Na+, K+, dan Ca2+penting dalam penghantaran impuls saraf dan kontraksi otot.
Apakah elektrolisis?
Elektrolisis adalah proses menggunakan arus elektrik langsung untuk memacu reaksi kimia bukan spontan. Elektrolisis boleh dilakukan dengan menggunakan sel elektrolisis. Teknik ini sangat penting untuk memisahkan sebatian ke dalam ion atau komponen lain.
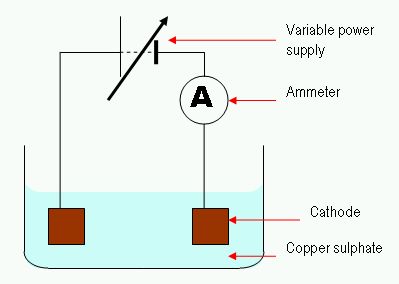
Rajah 02: Proses elektrolisis mudah
Dalam proses elektrolisis, arus elektrik melewati penyelesaian untuk pergerakan ion dalam penyelesaian tersebut. Biasanya, sel elektrolisis terdiri daripada dua elektrod yang direndam dalam penyelesaian yang sama. Kami memanggil penyelesaian ini elektrolit. Ciri penting dalam mengawal sel elektrolisis adalah "lebih berpotensi."Kita harus memberikan voltan yang lebih tinggi untuk menjalankan reaksi bukan spontan. Di sini, elektrod lengai juga boleh digunakan untuk menyediakan permukaan untuk reaksi yang berlaku.
Terdapat banyak aplikasi elektrolisis yang berguna. Satu aplikasi biasa ialah elektrolisis air. Di sini, air adalah elektrolit. Kemudian tindak balas pecahan molekul air ke dalam hidrogen dan gas oksigen dilakukan menggunakan arus elektrik yang dilalui melalui elektrolit.
Apakah perbezaan antara elektrolit dan elektrolisis?
Perbezaan utama antara elektrolit dan elektrolisis ialah elektrolit adalah bahan yang dapat menghasilkan ion, sedangkan elektrolisis adalah proses di mana arus elektrik digunakan untuk memacu reaksi kimia. Dalam erti kata lain, dalam elektrolit, bahan cair atau terlarut menghasilkan ion yang dapat bergerak dalam keadaan cecair atau dalam larutan berair, sementara dalam elektrolisis, penguraian elektrolit oleh arus elektrik berlaku. Elektrolit dan elektrolisis berkaitan antara satu sama lain dengan cara yang berbeza. Sebagai contoh, elektrolisis boleh berlaku di hadapan elektrolit.
Ringkasan -Elektrolis elektrolis
Oleh itu, perbezaan utama antara elektrolit dan elektrolisis ialah elektrolit adalah bahan yang dapat menghasilkan ion, sedangkan elektrolisis adalah proses di mana arus elektrik digunakan untuk memacu reaksi kimia. Dengan kata lain, elektrolit adalah bahan, sementara elektrolisis adalah proses.
Rujukan:
1. Helmenstine, Anne Marie. "Contoh kimia: elektrolit yang kuat dan lemah."Thoughtco, Aug. 6, 2019.
Ihsan gambar:
1. "Kekonduksian Elektrolit -Elektrik" oleh Elcap - Kerja Sendiri (CC0) melalui Wikimedia Commons
2. "Electrolysis Copper Sulphate" oleh Theresa Knott di Wikibooks Bahasa Inggeris. - Dipindahkan dari en.Wikibooks ke Commons. (CC BY-SA 3.0) melalui Commons Wikimedia


