Apakah perbezaan antara dimethylamine dan trimethylamine
The Perbezaan utama antara dimethylamine dan trimethylamine Adakah dimethylamine mengandungi atom nitrogen pusat yang dilampirkan dengan dua kumpulan metil ke atom nitrogen yang sama, manakala trimethylamine mengandungi tiga kumpulan metil yang dilampirkan pada atom nitrogen yang sama.
Dimethylamine dan Trimethylamine adalah dua sebatian amina penting yang berguna dalam banyak aplikasi perindustrian dan makmal yang berbeza.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu dimethylamine
3. Apa itu Trimethylamine
4. Dimethylamine vs Trimethylamine Group dalam bentuk jadual
5. Ringkasan -Dimethylamine vs Trimethylamine
Apa itu dimethylamine?
Dimethylamine adalah sebatian organik yang mempunyai formula kimia (CH3)2NH. Sebatian ini mempunyai dua kumpulan metil yang dilampirkan pada kumpulan amina. Oleh itu, atom nitrogen dalam kumpulan amina hanya mempunyai satu atom hidrogen yang dilampirkan kepadanya selain daripada kumpulan metil. Dimethylamine berlaku sebagai gas tidak berwarna dan mempunyai bau yang mencurigakan. Selain itu, jisim molarnya adalah 45.08 g/mol. Kami mengkategorikannya sebagai amina sekunder kerana dua kumpulan metil.
Sebatian ini berlaku secara semulajadi di banyak tumbuhan dan haiwan. Kita juga boleh menghasilkan sebatian ini melalui tindak balas antara metanol dan ammonia dengan kehadiran pemangkin, suhu tinggi, dan keadaan tekanan.
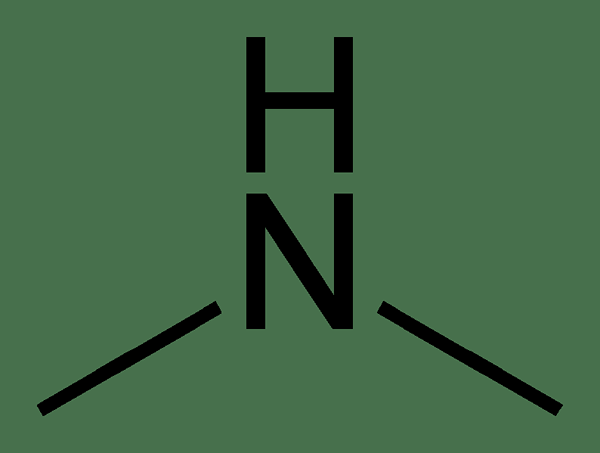
Rajah 1: Struktur kimia dimethylamine
Ketumpatan dimethylamine adalah 649.6 kg/m3. Titik lebur sebatian ini adalah -93 darjah Celsius, sedangkan titik mendidih boleh berkisar antara 7-9 darjah Celsius. Ia mempunyai kelarutan yang lemah di dalam air. Ia boleh bertindak balas dengan asid untuk membentuk garam, termasuk dimethylamine hydrochloride (yang merupakan pepejal putih yang tidak berbau yang mempunyai titik lebur 171.5 darjah Celsius). Kita juga boleh menghasilkan dimethylamine dari reaksi pemangkin metanol dan ammonia pada suhu tinggi dan tekanan tinggi.
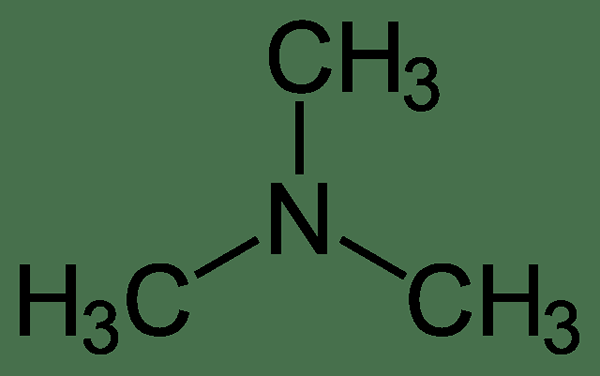
Apa itu Trimethylamine?
Trimethylamine adalah sebatian organik yang mempunyai formula kimia N (CH3)3. Kompaun ini boleh didapati sebagai amina tertiari yang tidak berwarna, hygroscopic, dan mudah terbakar yang berlaku sebagai gas pada suhu bilik, tetapi biasanya dijual di pasaran sebagai penyelesaian 40% dalam air. Ia adalah asas nitrogen yang boleh diprotonasi untuk mendapatkan kation trimethylammonium.

Rajah 02: Struktur kimia trimethylamine
Molekul trimethylamine dapat dikenal pasti sebagai nukleofil yang baik. Oleh itu, ia digunakan secara meluas dalam banyak aplikasi perindustrian. Ia juga berguna dalam sintesis kolin, tetramethylammonium hidroksida, pengawal selia pertumbuhan tumbuhan atau herbisida, resin pertukaran anion yang sangat asas, dan lain -lain. Apabila ia berada dalam kepekatan yang tinggi, ia mempunyai bau seperti ammonia, dan pada kepekatan yang lebih rendah, ia mempunyai bau yang mencurigakan. Pada kepekatan yang lebih tinggi, ia boleh menyebabkan nekrosis membran mukus pada sentuhan.
Jisim molar sebatian ini adalah 59.112 g/mol. Ketumpatan sebatian ini ialah 670 kg/m3. Titik lebur sebatian ini ialah -117.20 darjah Celsius, manakala titik mendidih adalah 3-7 darjah Celsius. Ia boleh didapati dengan air, dan tekanan wap adalah 188.7 kPa pada 20 darjah Celsius.
Apabila mempertimbangkan penyediaan trimethylamine, ia boleh disediakan oleh reaksi ammonia dan metanol dengan penggunaan pemangkin. Reaksi ini juga menghasilkan methylamine lain, seperti dimethylamine dan methylamine.
Apakah perbezaan antara dimethylamine dan trimethylamine?
Dimethylamine dan Trimethylamine adalah sebatian amina yang penting. Perbezaan utama antara dimethylamine dan trimethylamine ialah dimethylamine mengandungi atom nitrogen pusat yang dilekatkan dengan dua kumpulan metil ke atom nitrogen yang sama, manakala trimethylamine mengandungi tiga kumpulan metil yang dilampirkan pada atom nitrogen yang sama.
Cara membezakan dimethylamine dan trimethylamine?
Apabila kedua-dua sebatian ini dicampur dengan reagen Hinsberg secara berasingan, dimetilamine boleh menghasilkan N, N-dimetil benzena, yang tidak larut dalam larutan KOH berair kerana ia mempunyai dua kumpulan metil yang melekat pada atom nitrogen, sedangkan trimethylamine tidak bertindak balas dengan reagen ini kerana ia mempunyai tiga kumpulan metil yang dilampirkan pada atom nitrogen yang sama.
Infographic di bawah membentangkan perbezaan antara dimethylamine dan triethylamine dalam bentuk tabular untuk perbandingan bersebelahan.
Ringkasan -Dimethylamine vs Trimethylamine
Perbezaan utama antara dimethylamine dan trimethylamine ialah dimethylamine mengandungi atom nitrogen pusat yang dilampirkan dengan dua kumpulan metil ke atom nitrogen yang sama manakala trimethylamine mengandungi tiga kumpulan metil yang dilampirkan pada atom nitrogen yang sama.
Rujukan:
1. "Trimethylamine." Pusat Kebangsaan Maklumat Bioteknologi. Pangkalan Data Kompaun Pubchem, U.S. Perpustakaan Perubatan Negara.
Ihsan gambar:
1. "Dimethylamine-2D-Skeletal" (domain awam) melalui Wikimedia Commons
2. "Trimethylamine" oleh Neurotiker - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


