Apakah perbezaan antara pemangkin dan pertengahan
The Perbezaan utama antara pemangkin dan pertengahan adalah bahawa pemangkin berguna pada permulaan tindak balas dan diperbaharui pada akhir, sedangkan perantaraan terbentuk semasa tindak balas kimia dan tidak wujud pada akhir reaksi.
Istilah pemangkin dan pertengahan sangat penting dalam tindak balas kimia. Pemangkin adalah sebatian kimia yang dapat meningkatkan kadar tindak balas tanpa dimakan, sedangkan perantaraan adalah molekul yang terbentuk dari dua atau lebih reaktan dan mengalami reaksi selanjutnya untuk memberikan produk akhir.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu pemangkin
3. Apa itu pertengahan
4. Pemangkin vs pertengahan dalam bentuk jadual
5. Ringkasan -Pemangkin vs pertengahan
Apa itu pemangkin?
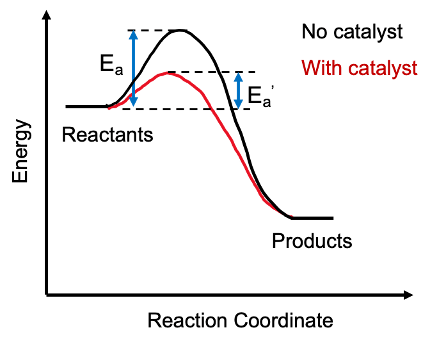
Pemangkin adalah sebatian kimia yang dapat meningkatkan kadar tindak balas tanpa dimakan. Oleh itu, sebatian ini dapat terus bertindak berulang kali. Oleh sebab itu, hanya sedikit pemangkin yang diperlukan untuk tindak balas kimia tertentu.
Pemangkin menyediakan laluan alternatif untuk tindak balas kimia dengan mengurangkan tenaga pengaktifan reaksi. Di sini, pemangkin menggabungkan dengan reaktan untuk menghasilkan produk perantaraan, dan setelah selesai reaksi yang diperlukan, pemangkin meninggalkan perantaraan dan regenerasi.
Terdapat dua jenis pemangkin; Mereka adalah pemangkin homogen dan heterogen. Dalam pemangkin homogen, molekul berada dalam fasa yang sama seperti molekul reaktan. Walau bagaimanapun, dalam pemangkin heterogen, molekul berada dalam fasa yang berbeza dengan molekul reaktan. Enzim adalah contoh pemangkin biologi yang baik.
Apa itu pertengahan?
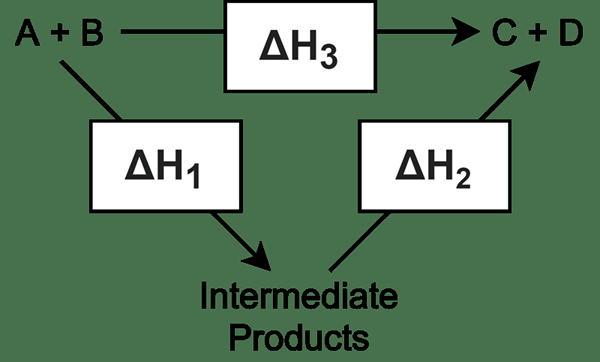
Perantaraan adalah molekul yang membentuk dari dua atau lebih reaktan dan mengalami reaksi selanjutnya untuk memberikan produk akhir. Perantaraan terbentuk dalam tindak balas pelbagai langkah. Kebanyakan masa, tindak balas kimia rumit memerlukan lebih daripada satu langkah untuk menyelesaikan reaksi untuk mendapatkan produk akhir yang dikehendaki. Dalam tindak balas ini, semua langkah tindak balas selain daripada langkah terakhir memberikan perantaraan; Langkah terakhir memberikan produk daripada memberi pertengahan. Oleh itu, pertengahan tidak stabil, dan ia cenderung dengan cepat menjalani tindak balas selanjutnya.

Biasanya, perantaraan berlaku dalam campuran tindak balas sangat jarang disebabkan oleh sifat tidak stabil. Mereka wujud dalam masa yang singkat. Lebih -lebih lagi, sangat sukar untuk mengasingkan pertengahan kerana ia cenderung bertindak lebih lanjut. Dalam tindak balas tertentu, terdapat jumlah molekul pertengahan yang sangat tinggi dalam setiap langkah reaksi. Kadang -kadang, sangat sukar untuk mengenal pasti molekul ini.
Kita boleh membezakan antara perantaraan dan getaran molekul. Ini biasanya mempunyai jangka hayat yang sama dan hanya peralihan. Biasanya, molekul ini sangat reaktif. Contoh yang baik adalah esterifikasi diol, di mana monoester dihasilkan dalam langkah pertama, dan dioester dibentuk pada langkah kedua (akhir).
Apakah perbezaan antara pemangkin dan pertengahan?
Perbezaan utama antara pemangkin dan pertengahan adalah bahawa pemangkin berguna pada permulaan tindak balas dan diperbaharui pada akhir, sedangkan perantaraan terbentuk semasa tindak balas kimia dan tidak wujud pada akhir reaksi. Selain itu, pemangkin stabil, sementara perantaraan sangat tidak stabil.
Infographic di bawah membentangkan perbezaan antara pemangkin dan pertengahan dalam bentuk jadual untuk perbandingan bersebelahan.
Ringkasan -Pemangkin vs pertengahan
Perbezaan utama antara pemangkin dan pertengahan adalah bahawa pemangkin ditambah pada permulaan tindak balas dan diperbaharui pada akhir tindak balas sedangkan perantaraan terbentuk semasa tindak balas dan tidak diperbaharui pada akhir reaksi.
Rujukan:
1. Helmenstine, Anne Marie, PH.D. "Apa itu reaksi pertengahan?"Thoughtco, Aug. 27, 2020.
Ihsan gambar:
1. "Rajah Tenaga Pemangkin" oleh Emma Ambrogi - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Rajah Kitaran Hess" oleh SGDWN - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


