Perbezaan antara asid lemah dan kuat
The Perbezaan utama antara asid yang lemah dan kuat ialah Asid lemah mengionkan sebahagiannya di dalam air manakala asid kuat mengionkan sepenuhnya.
Kekuatan asid adalah keupayaannya untuk mengionkan atau mendermakan ion hidrogen dalam larutan berair yang bertindak balas dengan air. Semakin banyak asid mengionkan, semakin kuat, dan pengeluaran ion hidrogen yang kurang menunjukkan asid lemah. Ini adalah perbezaan antara asid yang kuat dan lemah. Kepekatan ion dalam larutan akueus asid menceritakan betapa kuat atau lemah asid. Oleh itu, anda boleh mempunyai penyelesaian asid yang lemah, dan sangat mungkin untuk mempunyai penyelesaian cair asid yang kuat.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu asid lemah
3. Apa itu Asid Kuat
4. Perbandingan sampingan - lemah vs asid kuat dalam bentuk jadual
5. Ringkasan
Apa itu asid lemah?
Asid lemah merujuk kepada sebatian kimia yang sebahagiannya memisahkan ion dalam larutan berair. Mereka tidak melepaskan jumlah ion hidrogen yang boleh dilepaskan (h+) ke dalam penyelesaian. Untuk asid ini, pemisahan asid malar atau ka adalah nilai kecil. PH penyelesaian ini terletak sekitar 3 hingga 5. Terutamanya, ini kerana asid lemah ini tidak dapat menaikkan kandungan ion hidrogen dalam larutan seperti asid kuat.

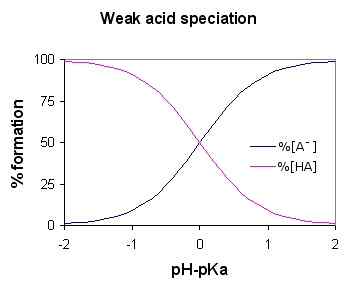
Rajah 01: Rajah spesiasi asid lemah (untuk asid lemah ha)
Oleh kerana asid lemah memisahkan sebahagiannya, larutan berair mengandungi tiga komponen utama; ion hidrogen, molekul asid bersatu dan asas konjugasi (anion terikat kepada ion hidrogen dalam molekul asid). Beberapa contoh biasa termasuk asid sulfur, asid fosforik, asid nitrous, dan lain -lain.
Apa itu Asid Kuat?
Asid kuat merujuk kepada molekul yang sepenuhnya memisahkan ion dalam larutan berair. Oleh itu, sebatian ini sepenuhnya mengionkan air. Nilai pemisahan asid pemalar atau ka adalah nilai yang tinggi untuk jenis asid ini. Lebih kuat asid, lebih mudah pembebasan ion hidrogen. Terutamanya, ini berlaku kerana polariti tinggi ikatan H-A di mana H adalah atom hidrogen, dan A adalah asas konjugasi. Untuk menjadi sangat kutub, perbezaan elektronegativiti antara atom di setiap sisi ikatan ini harus tinggi.
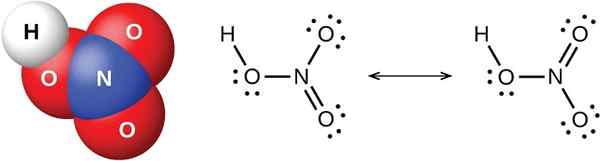
Rajah 02: Struktur kimia asid kuat HNO3 (asid nitrik)
Selain itu, pelepasan ion hidrogen ini juga bergantung pada saiz anion (asas konjugasi) yang mana ion hidrogen dilampirkan. Sekiranya anion besar dan lebih stabil, maka ia dapat dengan mudah melepaskan ion hidrogen. Tidak seperti asid lemah, asid kuat ini melepaskan semua ion hidrogen yang mungkin kepada larutan berair. Nilai pH penyelesaian berair ini sangat kecil; boleh berkisar antara 1 hingga 3.
Apakah perbezaan antara asid lemah dan kuat?
Asid lemah mengionkan sebahagiannya di dalam air manakala asid kuat mengionkan sepenuhnya. Oleh itu, pengionan adalah perbezaan utama antara asid yang lemah dan kuat. Selain itu, satu lagi perbezaan antara asid lemah dan kuat ialah asid lemah tidak menghilangkan semua atom hidrogen yang boleh dilepaskan. Sebaliknya, asid kuat melepaskan semua atom hidrogen yang mungkin.
Selain itu, terdapat perbezaan antara asid lemah dan kuat berdasarkan nilai pH mereka juga. Itu dia; Nilai pH asid lemah berkisar antara 3 hingga 5 manakala asid kuat berkisar antara 1 hingga 3. Juga, pemisahan asid tetap menyumbang kepada perbezaan lain antara asid yang lemah dan kuat. Pemisahan asid pemalar asid lemah adalah kecil berbanding asid kuat.
Ringkasan -lemah vs asid kuat
Asid adalah molekul yang dapat melepaskan ion hidrogen ke larutan berair. Kita boleh mengklasifikasikan semua asid sebagai asid kuat, asid yang agak kuat dan asid lemah. Ringkasnya, perbezaan utama antara asid yang lemah dan kuat ialah asid lemah mengionkan sebahagiannya di dalam air manakala asid kuat mengionkan sepenuhnya.
Rujukan:
1. Helmenstine, Anne Marie, PH.D. "Senarai asid yang kuat dan lemah."Pemikiran, Sep. 24, 2018. Terdapat di sini
2. Helmenstine, Anne Marie, PH.D. "Definisi dan contoh asid lemah dalam kimia."Pemikiran, Jun. 18, 2018. Terdapat di sini
Ihsan gambar:
1."Spesiasi Asid Lemah" oleh P. Gans dan dipindahkan oleh daun., (Domain Awam) melalui Wikimedia Commons
2."CNX Chem 18 09 HNO3" oleh OpenStax (CC oleh 4.0) melalui Commons Wikimedia


