Perbezaan antara asid lemah dan asid cairkan
The Perbezaan utama Antara asid lemah dan asid cair adalah bahawa Asid lemah adalah sebatian yang sebahagiannya memisahkan apabila dibubarkan di dalam air, sedangkan asid cair adalah larutan yang mengandungi lebih banyak air daripada asid.
Asid adalah sebatian yang boleh memisahkan air untuk melepaskan proton (ion hidrogen). Oleh itu, asid mempunyai pH lebih rendah daripada 7. Terdapat dua jenis asid sebagai asid kuat dan asid lemah mengikut kekuatan asid. Tetapi menurut kepekatan asid, terdapat dua jenis penyelesaian asid sebagai asid pekat dan cairkan asid.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu asid lemah
3. Apa itu asid cair
4. Perbandingan sampingan - asid lemah vs asid cair dalam bentuk jadual
5. Ringkasan
Apa itu asid lemah?
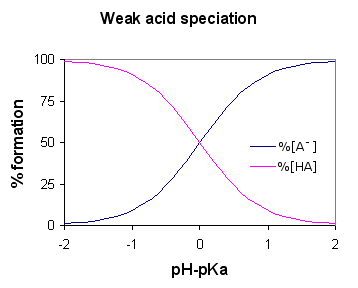
Asid lemah adalah sebatian yang sebahagiannya memisahkan ionnya apabila dibubarkan di dalam air. Bantuan lemah adalah asid konjugasi asas yang lemah. Selain itu, asid yang lemah mempunyai nilai pH yang tinggi berbanding dengan bantuan yang sama dengan kepekatan yang sama. Semasa menulis persamaan kimia untuk pemisahan asid lemah, kami menggunakan anak panah berganda untuk memasukkan reaksi ke hadapan dan ke belakang kerana pemisahan asid lemah boleh diterbalikkan.

Rajah 01: Spesiasi asid lemah (AH adalah asid lemah)
Asid lemah menjadi lemah kerana sifat kutub yang kurang dari sebatian asid; Jika sebatian lebih kutub, proton dengan mudah boleh meninggalkan molekul asid, tetapi di sini, kerana sebatian kurang kutub, sukar untuk memecahkan ikatan kimia. Beberapa contoh asid lemah termasuk asid asetik, asid formik, asid HF, hidrogen sulfida, dan lain -lain.
Apa itu asid cair?
Asid cair adalah larutan berair yang mempunyai kepekatan asid yang rendah. Maksudnya; Penyelesaian asid cair mempunyai lebih banyak air berbanding dengan kandungan asid. Asid cair boleh sama ada asid lemah atau asid yang kuat. Istilah "cair" hanya menerangkan kepekatan asid. Kebalikan dari asid cair adalah asid pekat.

Rajah 02: Asid HCl pekat
Tambahan pula, kita boleh mencairkan asid dengan menambahkan lebih banyak air. Walau bagaimanapun, menambahkan air ke asid pekat adalah berbahaya. Oleh itu, kaedah selamat adalah menambah asid ke air. Asid yang dicairkan sangat penting kerana menggunakan asid yang sangat pekat boleh menyebabkan luka bakar teruk jika menyentuh kulit.
Apakah perbezaan antara asid lemah dan asid cair?
Asid lemah berada di bawah klasifikasi asid mengikut kekuatan asid, sementara asid cair berada di bawah kategori kepekatan asid. Perbezaan utama antara asid lemah dan asid cair ialah asid lemah adalah sebatian yang sebahagiannya memisahkan apabila dibubarkan di dalam air, sedangkan asid cair adalah larutan yang mengandungi lebih banyak air daripada asid. Walau bagaimanapun, pencairan asid tidak menjejaskan kereaktifan asid. Maksudnya, asid kuat tidak menjadi asid lemah apabila pencairan. Tetapi, asid lemah kurang reaktif secara semula jadi.
Di bawah infographic meringkaskan perbezaan antara asid lemah dan asid cair.

Ringkasan -Asid lemah vs asid cair
Asid lemah berada di bawah klasifikasi asid mengikut kekuatan asid, dan asid cair berada di bawah kategori kepekatan asid. Perbezaan utama antara asid lemah dan asid cair ialah asid lemah adalah sebatian yang sebahagiannya memisahkan apabila dibubarkan di dalam air, sedangkan asid cair adalah larutan yang mengandungi lebih banyak air daripada asid.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi dan contoh asid lemah dalam kimia."Thoughtco, Mei. 5, 2019, Commons Wikimedia.
Ihsan gambar:
1. "Spesiasi asid lemah" oleh p. Gans, lukisan sendiri, pemuat naik adalah petragans di en.Wikipedia - dipindahkan dari en.Wikipedia ke Commons oleh Leaw (Domain Awam) melalui Commons Wikimedia
2. "Asid Hydrochloric 05" (domain awam) melalui Commons Wikimedia


