Perbezaan antara valensi dan elektron teras
The Perbezaan utama antara valensi dan elektron teras ialah elektron valensi mengambil bahagian dalam pembentukan ikatan kimia manakala elektron teras tidak.
Atom adalah blok bangunan semua bahan yang ada. Mereka sangat kecil sehingga kita tidak dapat memerhatikan mereka dengan mata kasar kita. Umumnya, atom berada dalam julat angstrom. Atom terdiri daripada nukleus, yang mempunyai proton dan neutron. Terdapat elektron yang mengelilingi nukleus di orbital. Sebilangan besar ruang dalam atom kosong. Daya yang menarik antara nukleus yang dikenakan positif (caj positif disebabkan oleh proton) dan elektron yang dikenakan negatif mengekalkan bentuk atom. Elektron tinggal di orbital sebagai pasangan dalam atom, dan mereka mempunyai berputar bertentangan. Selain itu, terdapat dua jenis elektron sebagai elektron valensi dan elektron teras.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah elektron valensi
3. Apa itu elektron teras
4. Perbandingan sampingan - Valence vs elektron teras dalam bentuk jadual
5. Ringkasan
Apakah elektron valensi?
Elektron valensi adalah elektron dalam atom yang mengambil bahagian dalam pembentukan ikatan kimia. Apabila bentuk bahan kimia, atom boleh mendapatkan elektron, menderma elektron, atau elektron saham. Keupayaan untuk menderma, memperoleh, atau berkongsi elektron ini bergantung kepada bilangan elektron valensi yang mereka ada. Contohnya, apabila h2 molekul dibentuk, satu atom hidrogen memberikan satu elektron kepada ikatan kovalen. Oleh itu, dua atom berkongsi dua elektron. Oleh itu, atom hidrogen mempunyai satu elektron valensi. Dalam pembentukan natrium klorida, satu atom natrium memberikan satu elektron, sedangkan atom klorin mengambil elektron. Ia berlaku untuk mengisi oktet di orbital valensi mereka. Di sana, natrium hanya mempunyai satu elektron valensi, dan klorin mempunyai tujuh. Oleh itu, dengan melihat elektron valensi, kita dapat menentukan kereaktifan kimia atom.
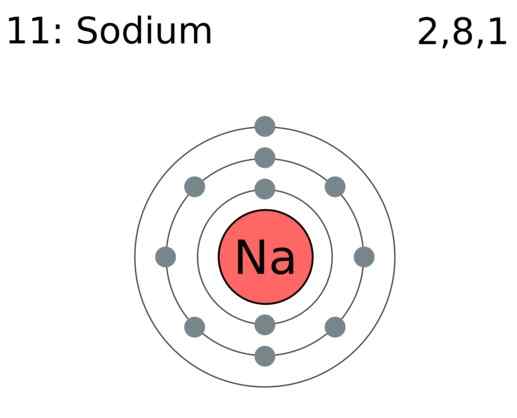
Rajah 01: Atom natrium mempunyai satu elektron valensi
Unsur Kumpulan Utama (Kumpulan I, II, III, dll ...) Mempunyai elektron valensi di cengkerang paling luar. Bilangan elektron valensi bersamaan dengan nombor kumpulan mereka. Atom inert telah menyelesaikan kerang dengan bilangan maksimum elektron valensi. Untuk logam peralihan, beberapa elektron dalaman juga bertindak sebagai elektron valensi. Bilangan elektron valensi dapat ditentukan dengan melihat konfigurasi elektron atom. Contohnya, nitrogen mempunyai konfigurasi elektron 1s2 2s2 2p3. Elektron di 2nd shell (yang merupakan nombor kuantum utama tertinggi dalam kes ini) diambil sebagai elektron valensi. Oleh itu, nitrogen mempunyai lima elektron valensi. Di samping mengambil bahagian dalam ikatan, elektron valensi adalah sebab kekonduksian terma dan elektrik unsur -unsur.
Apa itu elektron teras?
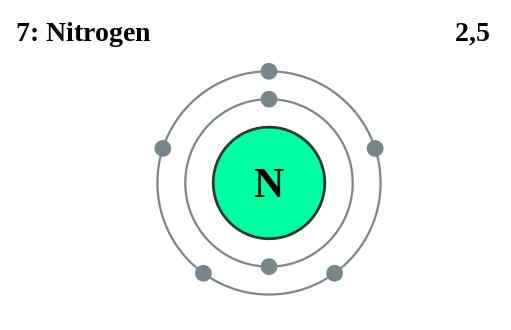
Elektron teras adalah elektron selain daripada elektron valensi atom. Oleh kerana elektron ini tinggal di lokasi dalaman atom, elektron teras tidak mengambil bahagian dalam pembentukan bon. Mereka tinggal di cengkerang dalaman atom. Contohnya, dalam atom nitrogen (1s2 2s2 2p3), lima elektron dari semua tujuh adalah elektron valensi, sedangkan dua elektron 1s adalah elektron teras.

Rajah 02: Nitrogen mempunyai dua elektron teras
Selain itu, tenaga yang diperlukan untuk mengeluarkan elektron teras dari atom sangat lebih tinggi daripada tenaga yang diperlukan untuk elektron valensi.
Apakah perbezaan antara elektron valensi dan teras?
Kedua -dua elektron valensi dan elektron teras bergerak di sekitar nukleus atom. Elektron valensi tinggal di kerang elektron paling luar manakala elektron teras tinggal di cengkerang dalaman. Sebagai contoh, atom nitrogen mempunyai 5 elektron valensi dan 2 elektron teras mengikut konfigurasi elektron; 1s2 2s2 2p3. Aboveall, perbezaan utama antara valensi dan elektron teras ialah elektron valensi yang mengambil bahagian dalam pembentukan ikatan kimia, tetapi elektron teras tidak.
Selain itu, satu lagi perbezaan yang signifikan antara elektron valensi dan teras ialah tenaga yang diperlukan untuk menghilangkan elektron teras sangat tinggi jika dibandingkan dengan tenaga yang diperlukan untuk menghilangkan elektron valensi.
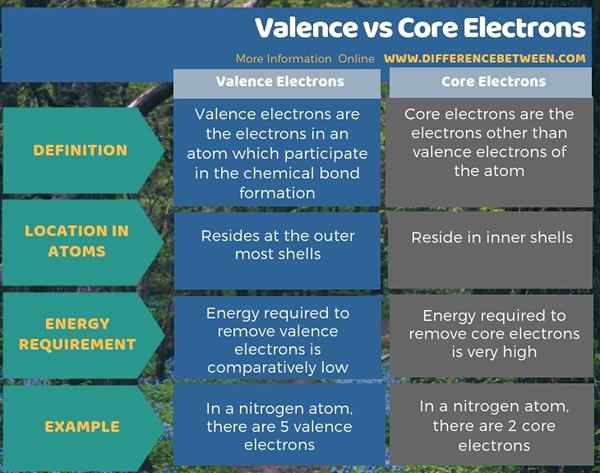
Ringkasan -Elektron teras valensi vs
Terdapat dua jenis elektron dalam atom sebagai elektron valensi dan elektron teras. Elektron valensi tinggal di cengkerang terluar manakala elektron teras berada di dalam cengkerang dalaman. Perbezaan utama antara valensi dan elektron teras adalah bahawa elektron valensi mengambil bahagian dalam pembentukan ikatan kimia manakala elektron teras tidak.
Rujukan:
1. "1.3: Elektron Valensi dan Valensi Terbuka."Kimia Libretexts, Libretexts, 23 Apr. 2019, boleh didapati di sini.
2. "1.9b: elektron valensi dan teras."Kimia Libretexts, Libretexts, 2 Mei 2019, boleh didapati di sini.
Ihsan gambar:
1. "Elektron Shell 011 Natrium" oleh Greg Robson - Aplikasi: Inkscape (CC BY -SA 2.0 uk) melalui Commons Wikimedia
2. "Elektron Shell 007 Nitrogen" Par Pumbaa (karya asal oleh Greg Robson) - Fail: Electron Shell 007 Nitrogen.PNG, (CC BY-SA 2.0 uk) melalui Commons Wikimedia


