Perbezaan antara tindak balas yang tidak biasa dan bimolecular
Perbezaan utama - Unimolekul vs reaksi bimolecular
Dalam kimia, istilah molekul digunakan untuk menyatakan bilangan molekul yang disatukan untuk bertindak balas dalam reaksi asas. Reaksi asas adalah tindak balas langkah tunggal yang memberikan produk akhir secara langsung selepas tindak balas antara reaktan. Ini bermakna reaksi asas adalah tindak balas kimia yang tidak mempunyai langkah pertengahan sebelum pembentukan produk akhir. Reaksi unimolecular dan bimolecular adalah reaksi asas seperti itu. The Perbezaan utama Antara reaksi yang tidak jelas dan bimolecular ialah Reaksi Unimolecular melibatkan hanya satu molekul sebagai reaktan manakala tindak balas bimolecular melibatkan dua molekul sebagai reaktan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah reaksi yang tidak biasa
3. Apakah reaksi bimolecular
4. Persamaan antara tindak balas yang tidak biasa dan bimolecular
5. Perbandingan sampingan - reaksi bimolecular vs bimolecular yang tidak simolekul dalam bentuk tabular
6. Ringkasan
Apakah reaksi yang tidak biasa?
Reaksi unimolecular adalah tindak balas asas yang melibatkan hanya satu molekul sebagai reaktan. Di sana, reaksi adalah reaksi penyusunan semula. Molekul tunggal menyusun semula untuk membentuk molekul yang lebih berbeza sebagai produk akhir. Tetapi ini berlaku dalam satu langkah. Tidak ada langkah pertengahan yang molekul reaktan mengalami pembentukan produk akhir. Ia secara langsung memberikan produk akhir. Persamaan untuk tindak balas dapat diberikan sebagai
A → p
Di sini adalah reaktan dan p adalah produk. Menurut urutan pertama undang -undang kadar, kadar tindak balas boleh diberikan seperti di bawah.
Kadar = k [reaktan]
Beberapa contoh tindak balas yang tidak biasa termasuk berikut:
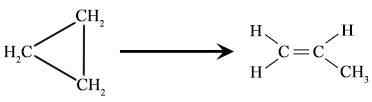
Rajah 01: Penyusunan semula Cyclopropane untuk membentuk propana.
- Penukaran n2O4 menjadi dua tidak2 molekul
- Penukaran siklopropan ke dalam propen
- Penukaran PCL5 ke PCL3 dan Cl2
Apakah reaksi bimolecular?
Reaksi bimolecular adalah tindak balas kimia asas yang melibatkan dua molekul sebagai reaktan. Ia boleh digambarkan sebagai perlanggaran dua molekul atau zarah. Ini adalah tindak balas kimia biasa dalam kimia organik dan bukan organik. Kedua -dua molekul boleh menjadi jenis yang sama atau berbeza. Sebagai contoh, kedua -dua molekul boleh menjadi dua molekul NOCL dengan susunan atom yang sama atau boleh C dan O2 mempunyai kombinasi atom yang berbeza. Persamaan untuk tindak balas bimolecular diberikan seperti di bawah.
A +A → P
A +b → p

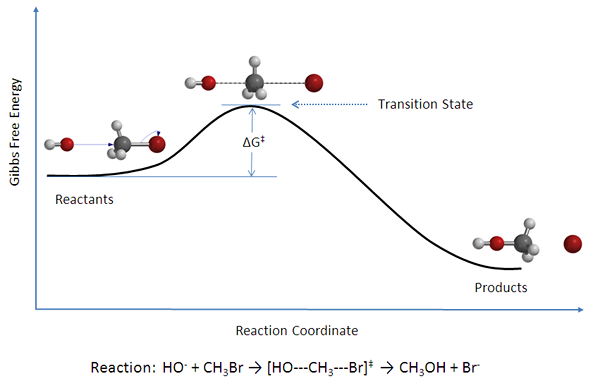
Rajah 02: Rajah tenaga untuk tindak balas bimolecular.
Oleh kerana terdapat dua reaktan, tindak balas ini dijelaskan sebagai reaksi pesanan kedua. Oleh itu, tindak balas bimolecular ini diterangkan oleh undang -undang kadar pesanan kedua;
Kadar = [a]2
Atau
Kadar = [a] [b]
Di mana pesanan keseluruhannya selalu 2. Beberapa contoh tindak balas bimolecular diberikan di bawah.
- Reaksi antara CO dan NO3
- Tindak balas antara dua molekul NOCL
- Reaksi antara Cl dan Ch4
Apakah persamaan antara tindak balas yang tidak biasa dan bimolecular?
- Kedua -dua tindak balas yang tidak penting dan bimolecular adalah tindak balas asas.
- Kedua -dua reaksi yang tidak jelas dan bimolecular memberikan produk dalam satu langkah.
- Kedua -dua reaksi yang tidak penting dan bimolecular tidak mempunyai langkah pertengahan.
Apakah perbezaan antara reaksi yang tidak biasa dan bimolecular?
Unimolecular vs reaksi biomolekul | |
| Reaksi unimolecular adalah tindak balas asas yang melibatkan hanya satu molekul sebagai reaktan. | Reaksi bimolecular adalah tindak balas kimia asas yang melibatkan dua molekul sebagai reaktan. |
| Reaktan | |
| Reaksi uniolecular mempunyai satu reaktan | Reaksi bimolecular mempunyai dua reaktan. |
| Perintah undang -undang kadar | |
| Reaksi unimolecular dijelaskan melalui urutan pertama undang -undang kadar. | Reaksi bimolecular dijelaskan melalui undang-undang kadar pesanan kedua. |
| Perintah keseluruhan | |
| Perintah keseluruhan persamaan kadar tindak balas unimolecular selalu 1. | Perintah keseluruhan persamaan kadar tindak balas bimolecular selalu 2. |
Ringkasan -Unimolecular vs reaksi bimolecular
Reaksi unimolecular dan bimolecular adalah tindak balas asas. Reaksi ini memberikan produk dalam satu langkah. Reaksi ini boleh dinyatakan menggunakan undang -undang kadar juga. Perbezaan antara tindak balas unimolecular dan bimolecular ialah tindak balas yang tidak sama sekali melibatkan satu reaktan manakala tindak balas bimolecular melibatkan dua molekul sebagai reaktan.
Muat turun pdf reaksi bimolecular unimolecular vs
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi PDF di sini: Perbezaan antara reaksi yang tidak biasa dan bimolecular
Rujukan:
1."Reaksi asas."Kimia Libretexts, Libretexts, 26 Mei 2017. Terdapat di sini
2."Reaksi Asas."Wikipedia, Yayasan Wikimedia, 10 Feb. 2018. Terdapat di sini
3."Molekul."Wikipedia, Yayasan Wikimedia, 13 Feb. 2018. Terdapat di sini
Ihsan gambar:
1.'Izomerisasi Cyclopropane'by Djokili92 - Kerja Sendiri, (CC BY -SA 4.0) melalui Commons Wikimedia
2.'RXN Coordinate Diagram 5'By Chem540GRP1F08 - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia


