Perbezaan antara pelarut dan larut

The Perbezaan utama antara pelarut dan larut adalah bahawa larut adalah orang yang akan dibubarkan sementara, pelarut bertanggungjawab untuk membubarkannya.
Penyelesaian adalah campuran homogen dua atau lebih bahan. Kami namakan campuran homogen kerana komposisi seragam sepanjang penyelesaian. Juga, komponen penyelesaian adalah terutamanya daripada dua jenis, larutan dan pelarut. Pelarut membubarkan larutan dan membentuk penyelesaian seragam. Oleh itu, jumlah pelarut biasanya lebih tinggi daripada kuantiti larut.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu pelarut
3. Apa itu larut
4. Perbandingan sampingan - pelarut vs larut dalam bentuk jadual
5. Ringkasan
Apa itu pelarut?
Pelarut adalah bahan dengan keupayaan larut. Oleh itu, ia dapat membubarkan bahan lain. Juga, pelarut boleh berlaku dalam keadaan cecair, gas atau pepejal. Walau bagaimanapun, yang paling biasa, kami menggunakan cecair sebagai pelarut. Selain itu, di antara cecair, air adalah biasa sebagai pelarut sejagat, kerana ia dapat membubarkan banyak bahan daripada pelarut lain. Selain itu, kita boleh membubarkan gas, pepejal, atau pelarut cecair lain dalam pelarut cecair. Tetapi, dalam pelarut gas, hanya larutan gas akan dibubarkan.

Rajah 01: Asid asetik berguna sebagai pelarut organik
Selain itu, terdapat had jumlah larutan yang dapat kita tambahkan kepada jumlah pelarut tertentu. Kami mengatakan penyelesaiannya telah menjadi tepu jika kami telah menambah jumlah maksimum larutan kepada pelarut. Terdapat pelarut dalam dua jenis sebagai pelarut organik atau bukan organik. Sebagai contoh, eter, heksana, dan metilena klorida adalah pelarut organik, sedangkan air adalah pelarut bukan organik.
Pelarut kutub dan bukan polar
Terdapat dua kategori pelarut yang luas sebagai pelarut kutub dan pelarut bukan polar.
Pelarut polar Oleh itu, molekul mempunyai pemisahan caj, oleh itu, mampu melarutkan larutan kutub. Dalam proses pembubaran, interaksi dipole-dipole atau interaksi dipole yang disebabkan dipole mungkin berlaku. Kita dapat membahagikan pelarut kutub lagi sebagai pelarut aprotik polar dan polar. Pelarut protik kutub mampu pembentukan ikatan hidrogen dengan larutan. Oleh itu, mereka melarutkan anion dengan ikatan hidrogen. Air dan metanol adalah pelarut protik kutub. Pelarut aprotik kutub tidak dapat membentuk ikatan hidrogen. Walau bagaimanapun, mereka mempunyai momen dipole yang besar, oleh itu membentuk interaksi dipole-dipole dengan larutan ionik, oleh itu, larut mereka. Acetone adalah pelarut aprotik kutub.
Pelarut bukan polar larut larutan bukan polar. Heksana, benzena, dan toluena adalah beberapa pelarut bukan kutub biasa.
Selain daripada pelarut yang dikelaskan di atas, terdapat beberapa pelarut, yang mempunyai sifat kutub dan bukan polar pertengahan. Menurut fenomena "seperti larut seperti", pelarut membubarkan larutan, yang sepadan dengan mereka.
Sifat
Sifat pelarut adalah penting untuk mengetahui bila kita menggunakannya di makmal. Contohnya, mengetahui titik -titik pelarut mendidih membantu kita menentukan cara menggunakan kaedah penyulingan untuk memisahkannya. Sebagai alternatif, ketumpatan pelarut adalah penting dalam teknik pengekstrakan pelarut. Turun naik, ketoksikan, dan mudah terbakar adalah beberapa parameter lain, yang perlu kita fokuskan ketika kita bekerja dengan pelarut yang berbeza.
Apa itu larut?
Larut adalah bahan yang larut dalam pelarut untuk membentuk penyelesaian. Larutan mungkin berlaku dalam fasa cecair, gas atau pepejal. Biasanya, dalam penyelesaian, larutan berada dalam jumlah yang lebih rendah daripada pelarut.

Rajah 02: Air garam mengandungi garam sebagai larutan
Apabila penyelesaian mempunyai jumlah larutan maksimum, ia dapat dibubarkan, maka kita mengatakan penyelesaiannya menjadi tepu. Pembubaran larut dalam pelarut mengubah sifat pelarut.
Apakah perbezaan antara pelarut dan larut?
Pelarut adalah bahan dengan keupayaan larut, oleh itu dapat membubarkan bahan lain sedangkan larut adalah bahan yang larut dalam pelarut untuk membentuk penyelesaian. Ini adalah perbezaan utama antara pelarut dan larut. Selain itu, terdapat beberapa perbezaan lain antara pelarut dan larut dalam keadaan fizikal mereka, kelarutan dan titik mendidih. Sebagai contoh, memandangkan titik mendidih, titik mendidih larut biasanya lebih tinggi daripada pelarut.
Infographic di bawah menunjukkan lebih banyak maklumat mengenai perbezaan antara pelarut dan larut.
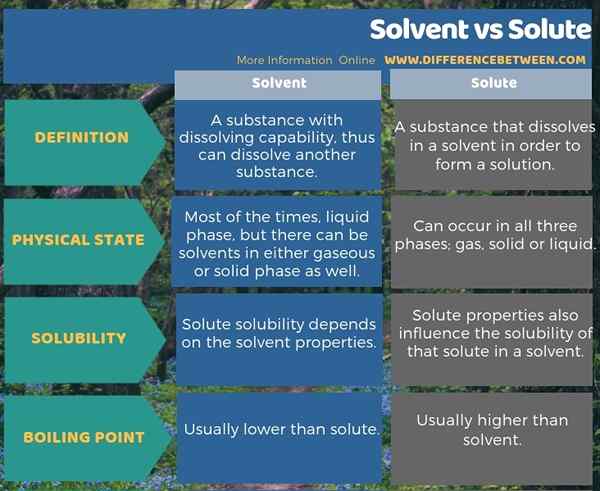
Ringkasan -pelarut vs larut
Larutan adalah bahan yang larut dalam pelarut untuk membentuk penyelesaian. Oleh itu, perbezaan antara pelarut dan larut adalah bahawa larut adalah orang yang dibubarkan, dan pelarut bertanggungjawab untuk membubarkannya.
Rujukan:
1. "Pelarut."Wikipedia, Yayasan Wikimedia, 6 Sept. 2018. Terdapat di sini
2. "Penyelesaian."Wikipedia, Yayasan Wikimedia, 21 Sept. 2018. Terdapat di sini
Ihsan gambar:
1."Asid Acetic" oleh W. OELEN (CC BY-SA 3.0) melalui Commons Wikimedia
2."SaltinWatersolutionliquid" oleh Chris 73 (CC BY-SA 3.0) melalui Commons Wikimedia


