Perbezaan antara keadaan singlet dan triplet
The Perbezaan utama antara singlet dan triplet keadaan ialah Negeri singlet hanya menunjukkan satu garis spektrum manakala keadaan triplet menunjukkan pemisahan tiga kali ganda garis spektrum.
Istilah singlet dan negara triplet dibincangkan di bawah mekanik kuantum. Kita dapat menerangkan istilah ini mengenai spin sistem, i.e. atom. Dalam mekanik kuantum, putaran bukan putaran mekanikal. Ia adalah konsep yang mencirikan momentum sudut zarah.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Negeri Singlet
3. Apakah keadaan triplet
4. Perbandingan sampingan - Negeri Singlet Vs Triplet dalam bentuk jadual
5. Ringkasan
Apa itu Negeri Singlet?
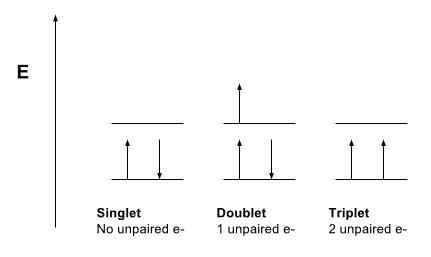
Negeri singlet merujuk kepada sistem di mana semua elektron dipasangkan. Momentum sudut bersih zarah dalam sistem jenis ini adalah sifar. Oleh itu, kita boleh mengatakan bahawa nombor kuantum spin keseluruhan, s adalah sifar (s = 0). Selain itu, jika kita mengambil spektrum sistem ini, ia menunjukkan satu garis spektrum, dan dengan itu, mendapat nama "Singlet State". Selain itu, hampir semua molekul yang kita tahu ada dalam keadaan singlet, tetapi oksigen molekul adalah pengecualian.

Rajah 1: Membandingkan Singlet, Doublet dan Negeri Triplet
Sebagai contoh, pasangan zarah terikat yang paling mudah yang mempunyai keadaan singlet adalah positronium, yang mempunyai elektron dan positron. Kedua -dua zarah ini terikat dengan cas elektrik yang bertentangan. Selain itu, elektron yang berpasangan dari sistem yang mempunyai keadaan tunggal mempunyai orientasi spin selari.
Apakah keadaan triplet?
Keadaan triplet sistem menggambarkan bahawa sistem mempunyai dua elektron yang tidak berpasangan. Momentum sudut zarah dalam sistem jenis ini ialah 1. Oleh itu, nombor kuantum putaran adalah 1. Selain itu, ini membolehkan tiga nilai momentum sudut sebagai -1, 0 dan +1. Oleh itu, garis spektrum yang kami peroleh untuk jenis sistem ini dibahagikan kepada tiga baris, dan dengan itu, mendapat nama triplet Nama.
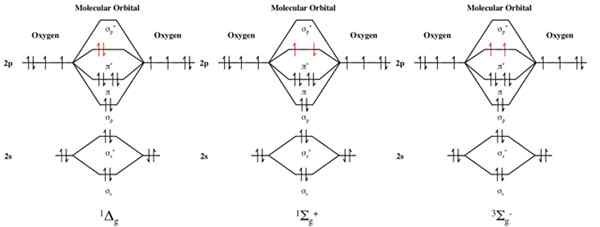
Ditunjukkan adalah tiga konfigurasi elektronik orbital molekul oksigen molekul, O2. Dari kiri ke kanan, gambar rajah adalah untuk: 1ΔG Singlet Oxygen (Negeri Teruja Pertama), 1 σ+ G Singlet Oxygen (keadaan kedua teruja), dan oksigen triplet 3σ- g (keadaan tanah).
Tambahan pula, contoh terbaik keadaan triplet ialah oksigen molekul. Pada suhu bilik, oksigen molekul ini memberikan pemisahan tiga kali ganda dalam garis spektrum.
Apakah perbezaan antara keadaan singlet dan triplet?
Negeri singlet merujuk kepada sistem di mana semua elektron dipasangkan. Sedangkan keadaan triplet sistem menggambarkan bahawa sistem mempunyai dua elektron yang tidak berpasangan. Perbezaan utama antara keadaan singlet dan triplet ialah keadaan singlet hanya menunjukkan satu garis spektrum manakala keadaan triplet menunjukkan pemisahan tiga kali ganda garis spektrum.
Selain itu, perbezaan selanjutnya antara keadaan singlet dan triplet ialah bilangan kuantum spin dari keadaan singlet adalah s = 0 sementara ia adalah s = 1 untuk keadaan triplet. Selain itu, hampir semua molekul yang kita tahu ada dalam keadaan tunggal kecuali oksigen molekul. Sedangkan, oksigen molekul berlaku di keadaan triplet.
Di bawah info-grafik meringkaskan perbezaan antara keadaan singlet dan triplet.
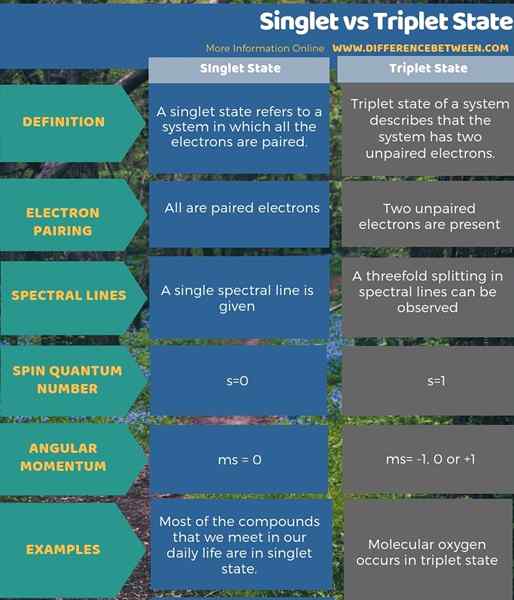
Ringkasan - Singlet vs Triplet State
Kita boleh membincangkan istilah keadaan singlet dan triplet sebagai fakta mengenai sistem minit seperti atom. Perbezaan utama antara keadaan singlet dan triplet ialah keadaan singlet hanya menunjukkan satu garis spektrum manakala keadaan triplet menunjukkan pemisahan tiga kali ganda garis spektrum.
Rujukan:
- "Negeri Triplet." Wikipedia, Yayasan Wikimedia, 16 Feb. 2019.
- "Negeri Singlet." Wikipedia, Yayasan Wikimedia, 27 Dis. 2018.
Ihsan gambar:
- "Gambarajah Multiplicity Spin" oleh LILLILEX - Kerja Sendiri, CC BY -SA 4.0, melalui Commons Wikimedia
- "Dua negeri bersemangat bersemangat dan keadaan triplet dioxygen molekul" oleh Angelo Frei - Kerja Sendiri, CC By -SA 3.0, melalui Commons Wikimedia


