Perbezaan antara potensi elektrod tunggal dan potensi elektrod standard
The Perbezaan utama antara potensi elektrod tunggal dan potensi elektrod standard ialah Potensi elektrod tunggal adalah potensi elektrod tunggal dalam sel elektrokimia manakala potensi elektrod standard adalah perbezaan potensi antara dua elektrod pada keadaan standard.
Sel elektrokimia adalah peranti yang boleh menjana elektrik menggunakan tindak balas kimia atau menggunakan elektrik untuk menyebabkan reaksi kimia. Ia mempunyai dua elektrod sebagai katod dan anod. Setiap elektrod dinamakan sebagai sel separuh, di mana reaksi separuh reaksi redoks berlaku. Elektrik dijana kerana potensi elektrik antara dua elektrod. Sekiranya kita menganggap potensi sel separuh, kita menyebutnya "potensi elektrod tunggal". Kita tidak dapat mengukurnya, dan ia sentiasa diukur berbanding dengan potensi elektrod lain.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah potensi elektrod tunggal
3. Apakah potensi elektrod standard
4. Perbandingan sampingan -potensi elektrod tunggal vs potensi elektrod standard dalam bentuk tabular
5. Ringkasan
Apakah potensi elektrod tunggal?
Potensi elektrod tunggal adalah potensi sel separuh sel elektrokimia. Sel elektrokimia mengandungi dua sel separuh. Umumnya, setiap separuh sel adalah elektrod logam. Logam ini melepaskan ion mereka ke dalam elektrolit (penyelesaian di mana elektrod direndam) jika terdapat litar terbuka. Oleh itu, elektrod ini dapat mengembangkan potensi elektrik di sekelilingnya. Oleh itu, inilah yang kita panggil sebagai potensi elektrod tunggal.

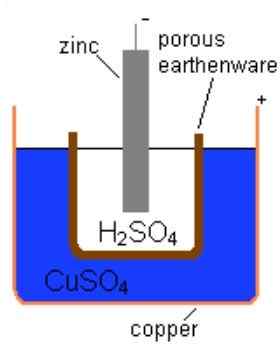
Rajah 01: Sel Daniel
Sebagai contoh, dalam sel Daniel, anod adalah zink, dan katod adalah tembaga. Di sini, anod mengembangkan caj negatif sementara katod mengembangkan caj positif. Caj ini secara individu menentukan potensi elektrod tunggal elektrod ini. Tambahan pula, terdapat tiga faktor yang berpotensi ini bergantung kepada; Kepekatan ion dalam larutan, kecenderungan untuk membentuk ion dan suhu.
Apakah potensi elektrod standard
Potensi elektrod standard adalah potensi sel separuh pada keadaan standard. Dalam sel elektrokimia, elektrik dijana hasil daripada perbezaan potensi antara dua elektrod. Tidak ada cara untuk mengukur potensi elektrod dengan mudah dan tepat. Selain itu, ia berbeza dengan suhu, kepekatan dan tekanan sistem. Oleh itu, kita perlu menentukan potensi elektrod standard.
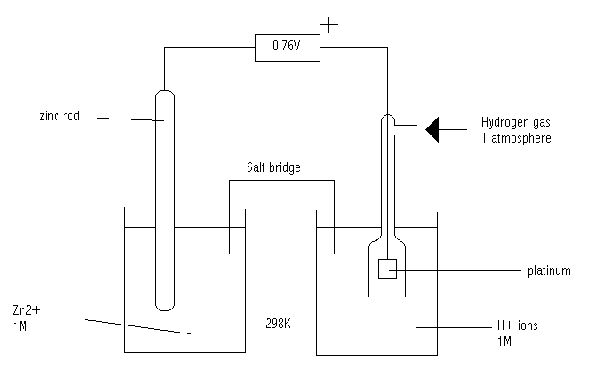
Rajah 02: Potensi elektrod standard zink
Potensi elektrod standard adalah potensi elektrod pada tekanan 1-atmosfera, suhu 25 ° C dan kepekatan molar 1m ion dalam elektrolit. Oleh kerana kita tidak dapat mengukur potensi elektrod individu, kita mengukur nilai standard ini terhadap potensi elektrod hidrogen standard.
Apakah perbezaan antara potensi elektrod tunggal dan potensi elektrod standard?
Sel elektrokimia mengandungi dua elektrod yang dikenali sebagai separuh sel. Potensi elektrik satu elektrod adalah potensi elektrod tunggal. Walau bagaimanapun, jika kita mengukurnya pada keadaan standard, maka kita menyebutnya potensi elektrod standard. Oleh itu, perbezaan utama antara potensi elektrod tunggal dan potensi elektrod standard ialah potensi elektrod tunggal adalah potensi elektrod tunggal dalam sel elektrokimia manakala potensi elektrod standard adalah perbezaan potensi antara dua elektrod pada keadaan standard. Selain itu, keadaan standard adalah potensi elektrod hidrogen standard.
Infographic di bawah menunjukkan lebih banyak maklumat mengenai perbezaan antara potensi elektrod tunggal dan potensi elektrod standard.

Ringkasan -potensi elektrod tunggal vs potensi elektrod standard
Sel elektrokimia mengandungi dua elektrod. Kami memanggil potensi elektrod "potensi elektrod tunggal". Perbezaan utama antara potensi elektrod tunggal dan potensi elektrod standard ialah potensi elektrod tunggal adalah potensi elektrod tunggal dalam sel elektrokimia manakala potensi elektrod standard adalah perbezaan potensi antara dua elektrod pada keadaan standard.
Rujukan:
1. "Potensi elektrod standard."Potensi elektrod standard, tersedia di sini.
2. "Potensi elektrod tunggal."Brainkart, boleh didapati di sini.
Ihsan gambar:
1. "Daniel Cell" oleh Kurzon di Bahasa Inggeris Wikipedia - dipindahkan dari EN.Wikipedia ke Commons oleh Armando-Martin menggunakan Commonshelper (Domain Awam) melalui Commons Wikimedia
2. "Potensi Elektrod Standard Zink" oleh Andyrendall - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


