Perbezaan antara ikatan tepu dan tak tepu
The Perbezaan utama antara bon tepu dan tak tepu ialah ikatan tepu tidak mempunyai ikatan pi manakala bon tak tepu selalu mempunyai bon pi.
Ikatan kimia adalah hubungan antara atom. Bon ini menyebabkan pembentukan molekul. Terdapat dua jenis bon utama; mereka adalah ikatan kovalen dan ikatan ionik. Walau bagaimanapun, bon dalam logam adalah ikatan logam. Bon Kovalen membentuk apabila dua atom berkongsi elektron valensi mereka. Ikatan kovalen ini boleh sama ada tepu atau tidak tepu bergantung pada bilangan dan jenis ikatan yang ada di antara dua atom.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah ikatan tepu
3. Apakah ikatan tak tepu
4. Perbandingan sampingan - tepu vs ikatan tak tepu dalam bentuk jadual
5. Ringkasan
Apakah ikatan tepu?
Ikatan tepu adalah ikatan tunggal. Ini adalah ikatan kimia kovalen. Di sana, dua atom mengikat antara satu sama lain melalui ikatan sigma, dan oleh itu, tidak ada ikatan PI - bentuk ikatan yang melibatkan dua elektron; satu elektron dari setiap dua atom yang membentuk ikatan ini. Elektron ini adalah elektron valensi atom. Kekuatan bon jenis bon ini agak lemah. Kedua -dua elektron bersama ada di antara atom, dan atom elektronegatif yang lebih banyak akan menarik elektron ke arah dirinya sendiri.
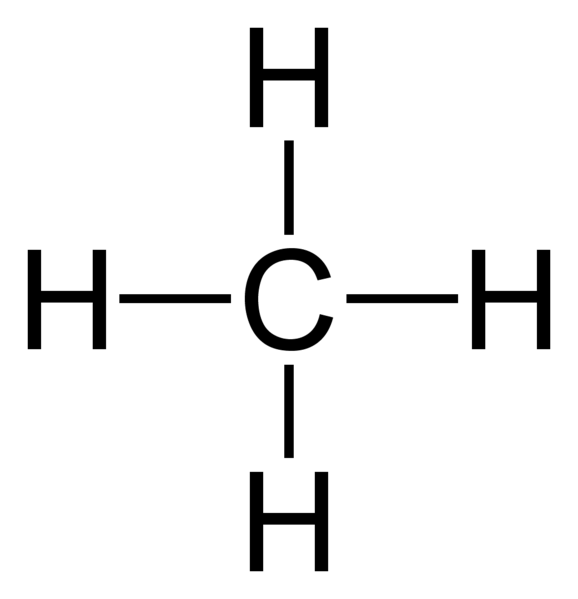
Rajah 01: Metana adalah sebatian tepu kerana ia mempunyai empat bon tepu
Selain itu, jenis bon ini mempunyai keupayaan untuk menjalani putaran. Di sana, bon ini bertindak sebagai paksi putaran. Bon tepu membentuk apabila mengikuti orbital bertindih antara satu sama lain.
- Dua orbital s
- Dua pz orbital
- S dan pz orbital
- Dua dz2 orbital
- Linear bertindih dari orbital hibrid.
Apakah ikatan tak tepu?
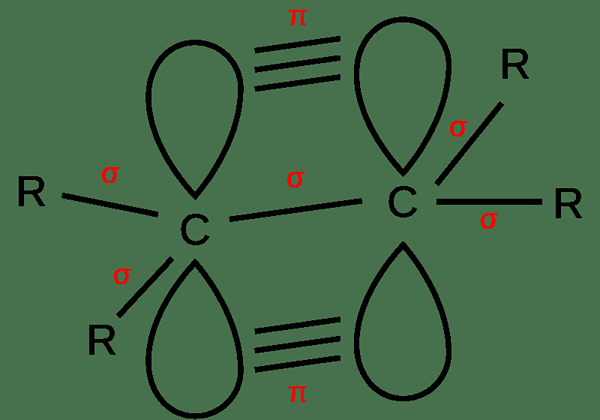
Ikatan tak tepu adalah ikatan berganda dan ikatan tiga di antara dua atom. Ini adalah ikatan kovalen. Oleh itu, elektron dikongsi antara atom. Selain itu, terdapat ikatan sigma dan bon PI juga. Dalam ikatan berganda, terdapat ikatan sigma dan ikatan Pi antara dua atom. Dalam ikatan triple, terdapat ikatan sigma dan dua ikatan pi. Bond sigma terbentuk kerana linear bertindih dari orbital atom manakala ikatan Pi terbentuk kerana selari bertindih.

Rajah 02: Pembentukan ikatan berganda
Juga, ikatan berganda mempunyai empat elektron ikatan antara atom manakala ikatan triple mempunyai enam elektron di sana. Kerana jumlah elektron yang besar antara atom dalam mengikat tak tepu, ikatan ini cenderung lebih reaktif. Selain itu, bon ini lebih kuat dan lebih pendek berbanding dengan bon tunggal.
Apakah perbezaan antara bon tepu dan tak tepu?
Ikatan tepu adalah ikatan tunggal, dan ikatan tak tepu adalah ikatan berganda dan ikatan tiga di antara dua atom. Perbezaan utama antara ikatan tepu dan tak tepu adalah bahawa ikatan tepu tidak mempunyai ikatan pi manakala bon tak tepu selalu mempunyai ikatan pi. Perbezaan selanjutnya antara ikatan tepu dan tak tepu adalah bahawa terdapat satu pasangan elektron antara dua atom dalam ikatan tepu manakala terdapat dua atau tiga pasangan elektron antara atom dalam ikatan tak tepu.
Tambahan pula, perbezaan penting antara ikatan tepu dan tak tepu adalah bahawa ikatan tepu agak lemah, panjang, dan kurang reaktif sedangkan, ikatan tak tepu adalah kuat, pendek, dan lebih reaktif. Selain itu, bon tepu boleh menjalani putaran sementara bon tak tepu tidak dapat.
Infographic di bawah adalah ringkasan perbandingan mengenai perbezaan antara bon tepu dan tak tepu.
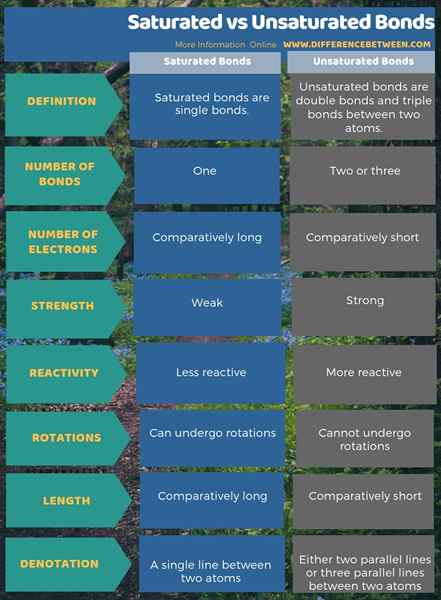
Ringkasan - Bon tepu vs tak tepu
Ringkasnya, bon tepu adalah ikatan kovalen tunggal manakala bon tak tepu adalah ikatan berganda dan tiga. Oleh itu, perbezaan utama antara ikatan tepu dan tak tepu adalah bahawa ikatan tepu tidak mempunyai ikatan pi manakala bon tak tepu selalu mempunyai bon pi.
Rujukan:
1. Helmenstine, Anne Marie, PH.D. "Definisi dan contoh ikatan berganda dalam kimia."Pemikiran, Sep. 8, 2017. Terdapat di sini
2. Britannica, editor Encyclopaedia. "Bond Triple."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 14 Apr. 2011. Terdapat di sini
Ihsan gambar:
1."Methane-2d-square" (Domain Awam) melalui Commons Wikimedia
2."Double Bond" oleh Fred the Oysteri (CC By-SA 4.0) melalui Commons Wikimedia


