Perbezaan antara radikal dan valensi
The Perbezaan utama antara radikal dan valensi ialah Radikal adalah spesies kimia yang mempunyai elektron yang tidak berpasangan, sedangkan valensi adalah konsep kimia yang menggambarkan keupayaan elemen kimia untuk bergabung dengan elemen kimia lain.
Radikal adalah spesies kimia yang sangat reaktif kerana ia mempunyai elektron yang tidak berpasangan. Valency adalah gabungan kuasa elemen, terutamanya yang diukur oleh bilangan atom hidrogen yang dapat menggantikan atau menggabungkan dengan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu radikal
3. Apa itu Valency
4. Perbandingan sampingan - Radikal vs Valency dalam bentuk jadual
5. Ringkasan
Apa itu radikal?
Radikal adalah spesies kimia yang mempunyai elektron yang tidak berpasangan. Elektron yang tidak berpasangan adalah elektron valensi. Maksudnya; ia berada di dalam shell paling luar atom. Radikal boleh menjadi atom, molekul atau ion. Oleh kerana kehadiran elektron yang tidak berpasangan tidak stabil, radikal adalah spesies kimia yang sangat reaktif. Oleh itu, spesies kimia ini mempunyai jangka hayat yang sangat singkat.
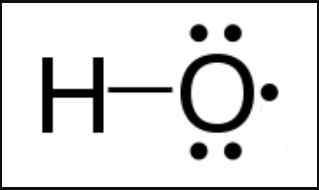
Rajah 01: Radikal hidroksil
Selanjutnya, radikal dapat menjana dengan cara yang berbeza. Kaedah biasa adalah reaksi redoks. Kaedah penting lain termasuk radiasi pengionan, haba, pelepasan elektrik, elektrolisis, dan lain -lain. Radikal ini adalah perantaraan banyak tindak balas kimia.
Apa itu Valency?
Valency adalah gabungan kuasa elemen, terutamanya yang diukur oleh bilangan atom hidrogen yang dapat menggantikan atau menggabungkan dengan. Ia adalah konsep kimia yang mengukur kereaktifan unsur kimia. Walau bagaimanapun, ia hanya dapat menggambarkan sambungan atom, tetapi ia tidak menggambarkan geometri sebatian.
Kita dapat menentukan valensi elemen kimia dengan memerhatikan kedudukan elemen itu dalam jadual berkala. Jadual berkala mempunyai semua elemen kimia mengikut bilangan elektron di shell paling luar atom. Bilangan elektron di shell paling luar menentukan valensi atom juga. Sebagai contoh, elemen kumpulan 1 dalam jadual berkala mempunyai satu elektron paling luar. Oleh itu, mereka mempunyai satu elektron untuk anjakan atau gabungan dengan atom hidrogen; Oleh itu, valensi adalah 1.

Rajah 02: Jadual berkala
Selain itu, kita dapat menentukan valensi menggunakan formula kimia sebatian. Di sini, asas kaedah ini adalah peraturan oktet. Menurut peraturan oktet, atom cenderung melengkapkan shell terluar dengan sama ada mengisi cangkang dengan elektron atau dengan mengeluarkan elektron tambahan. Sebagai contoh, jika kita menganggap NaCl kompaun, valensi Na adalah 1 kerana ia boleh mengeluarkan satu elektron yang ada di dalam shell terluar. Begitu juga, valensi CL juga 1 kerana ia cenderung untuk mendapatkan satu elektron untuk melengkapkan oktetnya.
Walau bagaimanapun, kita tidak boleh dikelirukan dengan nombor pengoksidaan istilah dan valensi kerana nombor pengoksidaan menerangkan caj yang boleh dibawa oleh atom. Sebagai contoh, valensi nitrogen adalah 3, tetapi nombor pengoksidaan boleh berubah dari -3 hingga +5.
Apakah perbezaan antara radikal dan valensi?
Perbezaan utama antara radikal dan valensi ialah radikal adalah spesies kimia yang mempunyai elektron yang tidak berpasangan, sedangkan valensi adalah konsep kimia yang menggambarkan keupayaan unsur kimia untuk bergabung dengan elemen kimia lain. Dari segi elektron, perbezaan antara radikal dan valensi adalah bahawa radikal mempunyai satu elektron yang tidak berpasangan, sementara valensi elemen kimia menggambarkan elektron dalam kulit paling luar.
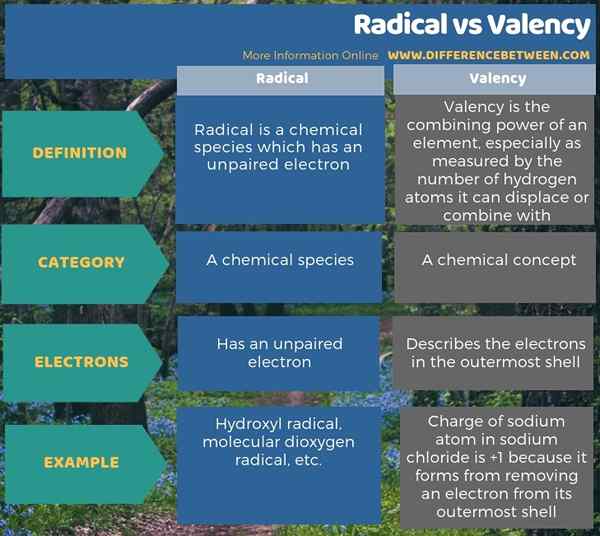
Ringkasan - Radikal vs Valency
Perbezaan utama antara radikal dan valensi ialah radikal adalah spesies kimia yang mempunyai elektron yang tidak berpasangan, sedangkan valensi adalah konsep kimia yang menggambarkan keupayaan unsur kimia untuk bergabung dengan elemen kimia lain.
Rujukan:
1. "Radikal (Kimia)." Wikipedia, Yayasan Wikimedia, 25 Jun 2019, boleh didapati di sini.
Ihsan gambar:
1. "Radikal Hidroksil" oleh Smokeyjoe - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Vektor Jadual Berkala" oleh Rubén Vera Koster - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


