Perbezaan antara orbital px py dan pz
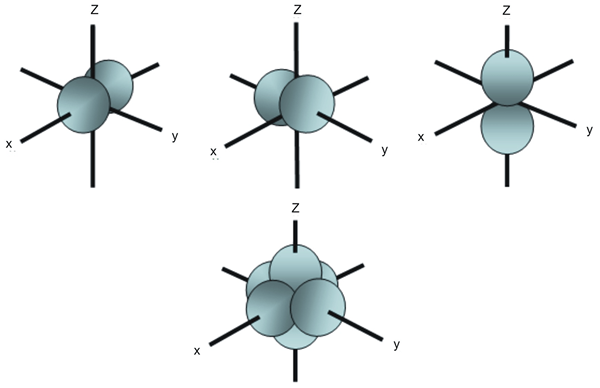
Perbezaan utama antara orbital px py dan pz ialah PX Orbital mempunyai dua lobus yang berorientasikan di sepanjang paksi-x dan orbital py mempunyai dua lobus yang berorientasikan di sepanjang paksi y sedangkan, orbital PZ mempunyai dua lobus yang berorientasikan di sepanjang paksi z. Oleh itu, perbezaan antara orbital px py dan pz timbul dari orientasi mereka di ruang angkasa.
Orbital atom adalah rantau di sekitar nukleus atom, yang mempunyai kebarangkalian tertinggi mencari elektron. Orbital atom boleh sama ada orbital, orbital p, orbital, atau orbital f. Tambahan pula, terdapat tiga orbital P; mereka adalah orbital px, py dan pz.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu orbital px
3. Apa itu orbital py
4. Apa itu orbital PZ
5. Persamaan antara orbital px py dan pz
6. Perbandingan sampingan - Px vs Py vs PZ orbitals dalam bentuk jadual
7. Ringkasan
Apa itu orbital px?
PX Orbital adalah salah satu daripada tiga orbital dan orientasi di sepanjang paksi x. Selain itu, orbital ini mempunyai dua lobus dan mempunyai bentuk dumbbell. Nombor kuantum adalah satu set nombor yang membantu menamakan orbital atom. Sistem ini memberikan orbital atom tertentu nama yang unik.

Rajah 1: Orbital P yang berbeza dan orientasi mereka
Nombor kuantum:
- Nombor kuantum prinsip (n) menerangkan cangkang elektron. Ex: n = 1, 2, 3 ..
- Nombor kuantum azimut atau nombor kuantum momentum sudut (l) menerangkan subshells. Ex: L = 0, 1, 2 ..
- Nombor kuantum magnet (m) menunjukkan keadaan kuantum unik elektron. Ex: M = ... -2, -1, 0, +1, +2 ..
- Nombor kuantum putaran (s) menerangkan putaran elektron. Ex: s = ±
Semasa mempertimbangkan orbital PX, notasi kuantum adalah seperti berikut.
- Apabila n = 1, tidak ada orbital p.
- Apabila n> 2, dan l = 1, terdapat orbital p. Kemudian, px sama ada m = +1 atau m = -1.
- Dengan nilai N yang semakin meningkat, saiz lobus luar orbital PX meningkat secara beransur -ansur manakala saiz lobus dalaman berkurangan.
Apa itu orbital py?
Orbital py adalah salah satu daripada tiga orbital p yang berorientasikan sepanjang paksi y. Orbital ini mempunyai dua lobus. Notasi kuantum orbital py adalah seperti berikut.
- Apabila n = 1, tidak ada orbital p.
- Apabila n> 2, dan l = 1, terdapat orbital p. Kemudian, py sama ada m = +1 atau m = -1.
- Dengan nilai N yang semakin meningkat, saiz lobus luar orbital py meningkat secara beransur -ansur manakala saiz lobus dalaman berkurangan.
Apa itu orbital PZ?
PZ Orbital adalah salah satu daripada tiga orbital p yang berorientasikan sepanjang paksi z. Orbital ini mempunyai dua lobus dan mempunyai bentuk dumbbell. Notasi kuantum orbital py adalah seperti berikut:
- Apabila n = 1, tidak ada orbital p.
- Apabila n> 2, dan l = 1, terdapat orbital p. Kemudian, pz sama ada m = 0.
- Dengan nilai N yang semakin meningkat, saiz lobus luar orbital PZ meningkat secara beransur -ansur manakala saiz lobus dalaman berkurangan.
Apakah persamaan antara orbital px py dan pz?
- Orbital px py dan pz mempunyai bentuk yang sama (bentuk dumbbell).
- Ketiga -tiga orbital P mempunyai saiz yang sama.
- Saiz orbital ini berubah dengan peningkatan nilai n.
- Ketiga orbital ini mengandungi dua lobus di sepanjang orientasi paksi yang sama.
Apakah perbezaan antara orbital px py dan pz?
Orbital Px Py vs PZ | ||
| Px Orbital adalah berorientasikan orbital p sepanjang paksi x. | Orbital py adalah berorientasikan orbital p sepanjang paksi y. | PZ Orbital adalah berorientasikan orbital poil di sepanjang paksi z. |
| Orientasi | ||
| Di sepanjang paksi-x | Di sepanjang paksi-y | Di sepanjang paksi z |
| Nilai nombor kuantum magnet (m) | ||
| Nilai untuk nombor kuantum magnet (m) sama ada +1 atau -1. | Nilai untuk nombor kuantum magnet (m) sama ada +1 atau -1 | Nilai untuk nombor kuantum magnet (m) ialah 0 (sifar) |
Ringkasan -orbital px py vs pz
Terdapat tiga orbital atom P dalam atom. Nama PX, PY dan PZ, menunjukkan orientasi orbital di ruang angkasa. Perbezaan utama antara orbital Px Py dan Pz ialah Px Orbital mempunyai dua lobus yang berorientasikan di sepanjang paksi-x dan orbital Py mempunyai dua lobus yang berorientasikan di sepanjang paksi-y manakala orbital pz mempunyai dua lobus berorientasikan di sepanjang paksi z di sepanjang paksi z.
Rujukan:
1. "Orbital atom."Wikipedia, Yayasan Wikimedia, 24 Apr. 2018, boleh didapati di sini.
2. Libretexts. "Orbital atom."Kimia Libreetexts, Libretexts, 7 Feb. 2018, boleh didapati di sini.
3. Agray, Santosh. "Bentuk orbital."Meja Kimia, boleh didapati di sini.
Ihsan gambar:
1."PX PY PZ Orbitals" oleh Yayasan CK -12 - Fail: Kimia Sekolah Tinggi.PDF, halaman 268 (CC BY-SA 3.0) melalui Commons Wikimedia


