Perbezaan antara protonasi dan pengionan
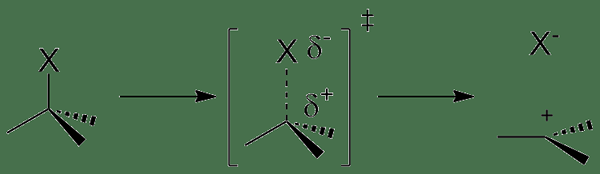
The Perbezaan utama antara protonasi dan pengionan adalah bahawa Protonasi adalah penambahan proton kepada spesies kimia, sedangkan pengionan adalah penyingkiran atau memperoleh elektron dari spesies kimia.
Protonasi dan pengionan adalah dua konsep kimia yang penting dalam menggambarkan tingkah laku ionik spesies kimia.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu protonasi
3. Apakah pengionan
4. Perbandingan sampingan - protonasi vs pengionan dalam bentuk jadual
5. Ringkasan
Apa itu protonasi?
Protonasi adalah penambahan proton kepada spesies kimia seperti atom, molekul, atau ion. Ini membentuk asid konjugasi spesies kimia yang sepadan. Protonasi dapat digambarkan sebagai tindak balas kimia asas, dan ia merupakan langkah penting dalam banyak proses stoikiometri dan pemangkin.
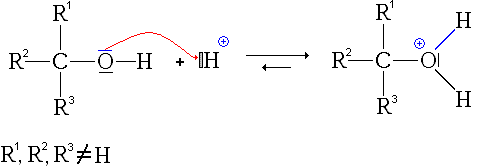
Rajah 01: Reaksi protonasi
Terdapat dua jenis proses protonasi yang dikenali sebagai protonasi monobasic dan protonasi polybasic. Protonasi monobasic adalah protonasi tunggal yang berlaku di beberapa ion dan molekul. Tetapi dalam beberapa ion dan molekul, terdapat lebih daripada satu protonasi, dan kita boleh menamakannya sebagai spesies kimia polybasic. Sifat polybasic ini benar untuk banyak makromolekul biologi.
Apakah pengionan?
Pengionan adalah proses kimia di mana atom atau molekul mendapat caj positif atau negatif. Proses ini berlaku kerana sama ada mengeluarkan atau mendapatkan elektron dari atom atau molekul. Dalam proses pengionan, kita boleh menamakan ion yang dihasilkan sebagai anion dan kation, bergantung pada pertuduhan yang mereka ada, i.e. kation adalah ion dan anion positif yang dikenakan ion negatif. Pada asasnya, kehilangan elektron dari atom neutral atau molekul membentuk kation, dan keuntungan elektron dari atom neutral memberikannya caj negatif, membentuk anion.
Apabila elektron dikeluarkan dari atom gas neutral dengan penambahan tenaga, ia membentuk kation monovalen. Ini kerana atom neutral mempunyai bilangan elektron dan proton yang sama, menyebabkan tiada caj bersih; Apabila kita mengeluarkan elektron dari atom itu, terdapat satu proton berlebihan yang tidak mempunyai elektron untuk meneutralkan cajnya. Oleh itu, atom itu mendapat caj +1 (ia adalah caj proton). Jumlah tenaga yang diperlukan untuk ini adalah tenaga pengionan pertama atom itu.
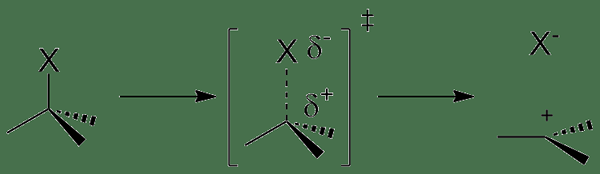
Rajah 02: Reaksi pengionan
Selain itu, pengionan yang berlaku dalam penyelesaian cecair adalah pembentukan ion dalam penyelesaian. Contohnya, apabila molekul HCl dibubarkan di dalam air, ion hidronium (H3O+) terbentuk. Di sini, HCL bertindak balas dengan molekul air dan bentuk ion hidronium yang dikenakan secara positif dan klorida yang dikenakan negatif (CL-) ion.
Tambahan pula, pengionan mungkin berlaku melalui perlanggaran. Tetapi jenis pengionan ini berlaku terutamanya dalam gas apabila arus elektrik melalui gas. Sekiranya elektron dalam arus mempunyai jumlah tenaga yang mencukupi untuk mengeluarkan elektron dari molekul gas, mereka akan memaksa elektron dari molekul gas, menghasilkan pasangan ion yang terdiri daripada ion positif individu dan elektron negatif. Di sini, ion negatif juga terbentuk kerana sesetengah elektron cenderung melekat pada molekul gas dan bukannya menarik elektron keluar.
Selain itu, pengionan berlaku apabila tenaga radiasi atau zarah -zarah yang dikenakan dengan cukup bertenaga melalui pepejal, cecair atau gas; Sebagai contoh, zarah alfa, zarah beta, dan radiasi gamma dapat mengionkan bahan; Oleh itu, kami menamakan mereka pengionan radiasi.
Apakah perbezaan antara protonasi dan pengionan?
Protonasi dan pengionan adalah konsep kimia penting dalam kimia. Perbezaan utama antara protonasi dan pengionan ialah protonasi adalah penambahan proton kepada spesies kimia, sedangkan pengionan adalah penyingkiran atau mendapatkan elektron dari spesies kimia.
Infographic di bawah meringkaskan perbezaan antara protonasi dan pengionan dalam bentuk jadual.
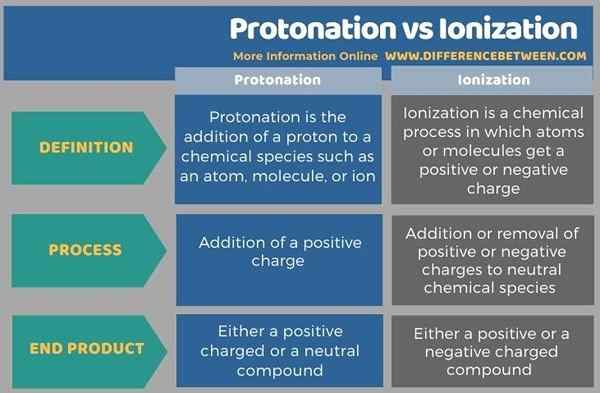
Ringkasan -Protonasi vs pengionan
Protonasi dan pengionan bertentangan antara satu sama lain kerana protonasi merujuk kepada penambahan sementara pengionan merujuk kebanyakannya kepada pemecahan ikatan. Perbezaan utama antara protonasi dan pengionan ialah protonasi adalah penambahan proton kepada spesies kimia, sedangkan pengionan adalah penyingkiran atau mendapatkan elektron dari spesies kimia.
Rujukan:
1. "Pengionan." Encyclopædia Britannica, Encyclopædia Britannica, Inc., Terdapat di sini.
Ihsan gambar:
1. "Protonasi d'un alcool terticaire" oleh pemuat naik asal adalah Rhadamante di Wikipedia Perancis. - Dipindahkan dari fr.Wikipedia ke Commons oleh Bloody-Libu menggunakan Commonshelper. (CC BY-SA 3.0) melalui Commons Wikimedia
2. "Reaksi Pengion" oleh CSEIZERT - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


