Perbezaan antara PKA dan PKB
Perbezaan utama - PKA vs PKB
PKA dan PKB adalah istilah umum dalam kimia yang dikenali sebagai pemalar pemisahan. PKA adalah pemisahan asid pemalar, dan PKB adalah pemisahan asas pemalar. Syarat -syarat ini digunakan untuk menjadikannya mudah untuk bekerja dengan nilai yang sangat besar atau sangat kecil. "P" dalam istilah ini bermaksud "logaritma negatif". The Perbezaan utama antara PKA dan PKB ialah PKA adalah logaritma negatif KA manakala PKB adalah logaritma negatif KB.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu PKA
3. Apa itu PKB
4. Hubungan antara PKA dan PKB
5. Perbandingan sampingan - PKA vs PKB dalam bentuk jadual
6. Ringkasan
Apa itu PKA?
PKA adalah logaritma negatif ka. KA adalah pemalar pemisahan asid penyelesaian. Ia adalah pengukuran kuantitatif kekuatan asid dalam larutan. Asid adalah sebatian kimia yang dapat melepaskan satu atau lebih ion hidrogen (proton) ke penyelesaian. Jika pemisahan asid tetap; KA lebih tinggi, ini bermakna asid sepenuhnya (atau hampir sepenuhnya) dipisahkan ke dalam ion yang membentuk ion hidrogen. Kemudian, ia menunjukkan bahawa asid adalah asid yang kuat. Oleh kerana PKA adalah nilai logaritma negatif KA, PKA adalah nilai yang lebih kecil untuk asid kuat.
pka = -log10Ka
Menurunkan pka vlaue, semakin kuat asid. Begitu juga, lebih tinggi nilai PKA, semakin lemah asid. Dengan melihat nilai PKA asid yang berbeza, seseorang dapat membandingkan kekuatan asid relatif. Daripada menggunakan nilai KA, nilai PKA digunakan secara umum kerana ia lebih mudah untuk bekerja dengan jumlah yang sangat besar atau sangat kecil dengan tempat perpuluhan kecil.

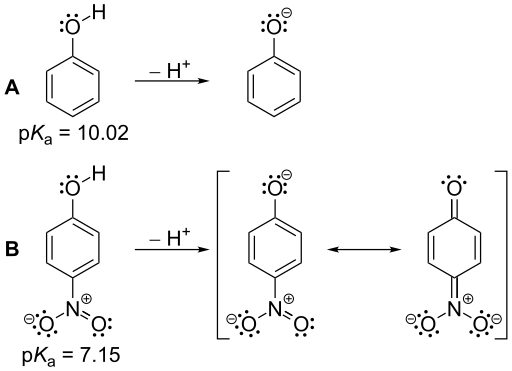
Rajah 01: Nilai PKA fenol dan nitrophenol: nitrophenol adalah asid yang lebih kuat daripada fenol kerana nilai PKA yang lebih kecil berbanding nitrophenol.
Selain daripada membandingkan kekuatan asid, nilai PKA juga digunakan untuk memilih buffer yang sesuai. Menurut persamaan Henderson-Hasselbalch, terdapat hubungan antara pH dan PKA sistem.
ph = pka + log10([A-]/[Ah])
Untuk pemisahan asid HA. Persamaan ini boleh ditulis semula seperti di bawah.
Ka/[H+] = [A-]/[Ah]
Mengikut persamaan ini, nilai PKA dan pH sistem yang sama adalah sama apabila separuh asid telah dipisahkan. Oleh kerana kapasiti penimbunan sistem adalah keupayaannya untuk mengekalkan pH penyelesaian, penampan harus dipilih di mana PKA dan pH sangat dekat antara satu sama lain.
Apa itu PKB?
PKB adalah logaritma negatif KB. Kb adalah pemisahan asas pemalar. Ia digunakan untuk menentukan kekuatan asas kuantitatif. Apabila asas dibubarkan di dalam air, ia memisahkan ion yang membentuk penyelesaian asas. Pangkalan yang kuat memisahkan sepenuhnya. Pangkalan lemah memisahkan sebahagiannya.
pkb = -log10Kb
"P" di PKB bermaksud "logaritma negatif". Oleh kerana kebanyakan nilai kb sangat besar atau sangat kecil, logaritma negatif nilai -nilai ini digunakan untuk memudahkannya. Oleh itu, nilai kb yang besar boleh dicirikan oleh nilai pkb kecil dengan tempat perpuluhan kecil.
Apakah hubungan antara PKA dan PKB?
Hubungan antara ka dan kb diberikan seperti di bawah.
Kw = ka.Kb
Kemudian hubungan antara PKA dan PKB diberikan sebagai, (pada 25oC)
PKA + PKB = 14
Apakah perbezaan antara PKA dan PKB?
PKA vs PKB | |
| PKA adalah logaritma negatif KA. | PKB adalah logaritma negatif KB. |
| Alam | |
| PKA diberikan untuk asid. | PKB diberikan untuk pangkalan. |
| Hubungan dengan pemisahan pemisahan | |
| PKA berkaitan dengan pemisahan asid yang berterusan. | PKB berkaitan dengan pemisahan asas pemisahan. |
| Petunjuk | |
| Lebih kecil nilai PKA, lebih kuat asid. | Lebih kecil nilai pkb, lemah asas. |
Ringkasan - PKA vs PKB
PKA dan PKB digunakan untuk membandingkan kekuatan asid dan pangkalan masing -masing. PKA diberikan untuk pemisahan asid. PKB diberikan untuk pemisahan pangkalan. Perbezaan antara PKA dan PKB ialah PKA adalah logaritma negatif KA manakala PKB adalah logaritma negatif KB.
Muat turun PDF PKA vs PKB
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi PDF di sini: Perbezaan antara PKA dan PKB
Rujukan:
1.Helmenstine, Anne Marie, D. "Definisi PKA dalam Kimia."Pemikiran, Sep. 15, 2017. Terdapat di sini
2.Helmenstine, Anne Marie, D. "Hubungan PH dan PKA: Persamaan Henderson-Hasselbalch."Thoughtco, dec. 1, 2017. Terdapat di sini
3."Hubungan antara ka dan kb."Akademi Khan. Terdapat di sini
Ihsan gambar:
1.'Pka phenol vs nitrophenol'by hbf878 - kerja sendiri, (domain awam) melalui commons wikimedia


