Perbezaan antara penambahan oksidatif dan penghapusan reduktif
The Perbezaan utama antara penambahan oksidatif dan penghapusan reduktif ialah Penambahan oksidatif merujuk kepada penambahan dua ligan anionik ke kompleks logam, sedangkan penghapusan reduktif merujuk kepada penyingkiran dua ligan anionik dari kompleks logam.
Penambahan oksidatif dan penghapusan reduktif adalah tindak balas kimia yang bertentangan antara satu sama lain. Kedua -dua proses ini berkaitan dengan kompleks koordinasi yang mengandungi logam peralihan dan ligan yang dilampirkan kepadanya.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu penambahan oksidatif
3. Apakah penghapusan reduktif
4. Perbandingan sampingan -Penambahan oksidatif vs penghapusan reduktif dalam bentuk jadual
5. Ringkasan
Apa itu penambahan oksidatif
Penambahan oksidatif adalah sejenis tindak balas bukan organik di mana dua ligan anionik dilampirkan pada kompleks koordinasi. Kita boleh menunjukkan proses ini sebagai OA. Di sini, ligan anionik biasanya terbentuk dari molekul jenis A-B. Proses terbalik sebenar tindak balas ini - di mana dua ligan anionik meninggalkan kompleks koordinasi yang membentuk molekul jenis A -B - dikenali sebagai penghapusan reduktif. Oleh kerana tindak balas ini melibatkan peningkatan bilangan ligan di kompleks koordinasi, bilangan koordinasi juga meningkat dengan penambahan oksidatif. Oleh itu, kiraan elektron valensi kompleks juga meningkat sebanyak dua unit. Untuk tindak balas jenis ini berlaku, kompleks koordinasi harus tidak tepu atau kekurangan elektron.
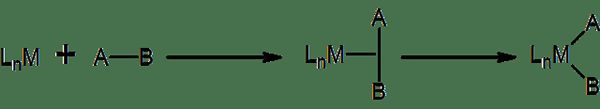
Rajah 01: Lakaran umum untuk penambahan oksidatif
Umumnya, penambahan oksidatif mengubah kompleks koordinasi elektron 16-valensi menjadi kompleks elektron 18-valensi. Tambahan pula, penambahan oksidatif boleh berlaku sebagai penambahan oksidatif binuklear. Di sini, dua pusat logam menjalani perubahan keadaan pengoksidaan, dan keadaan pengoksidaan mereka meningkat sebanyak satu unit, yang memberikan jumlah kenaikan dua unit.
Apakah penghapusan reduktif?
Penghapusan Reduktif adalah penyingkiran dua ligan anionik dari kompleks logam, yang bertentangan dengan tindak balas tambahan oksidatif. Proses ini mengurangkan keadaan pengoksidaan rasmi logam kompleks koordinasi, dan nombor koordinasi mengurangkan dua unit.

Rajah 02: Lakaran umum untuk penghapusan reduktif
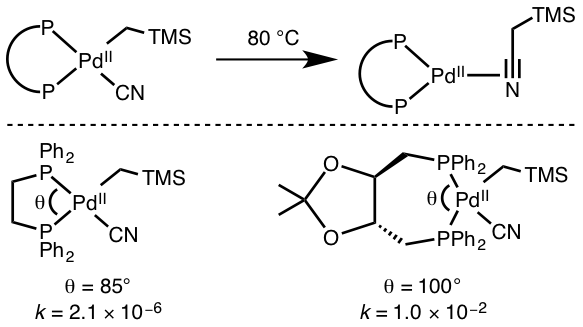
Kita dapat melihat jenis reaksi ini dalam kompleks koordinasi yang mengandungi logam yang mempunyai d6 dan d8 sistem elektron. Reaksi jenis ini boleh berlaku dengan penukaran kompleks elektron 18-valensi ke dalam kompleks elektron 16-valensi dan melalui tindak balas penghapusan binuklear. Dalam tindak balas penghapusan binuklear, dua kompleks logam mengurangkan keadaan pengoksidaan rasmi mereka dengan satu unit dan memberikan pengurangan dua unit keadaan pengoksidaan rasmi dan kiraan elektron valensi.
Apakah perbezaan antara penambahan oksidatif dan penghapusan reduktif?
Penambahan oksidatif dan penghapusan reduktif adalah tindak balas yang bertentangan antara satu sama lain. Perbezaan utama antara penambahan oksidatif dan penghapusan reduktif ialah penambahan oksidatif merujuk kepada penambahan dua ligan anionik ke kompleks logam, sedangkan penghapusan reduktif merujuk kepada penyingkiran dua ligan anionik dari kompleks logam. Selain itu, dalam penambahan oksidatif, kiraan elektron valensi dan keadaan pengoksidaan formal meningkat sebanyak dua unit, tetapi dalam tindak balas penghapusan reduktif, keadaan pengoksidaan formal dan kiraan elektron valensi menurun sebanyak dua unit.
Berikut adalah penerangan terperinci tentang perbezaan antara penambahan oksidatif dan penghapusan reduktif.

Ringkasan -Penambahan oksidatif vs penghapusan reduktif
Penambahan oksidatif dan penghapusan reduktif adalah tindak balas kimia yang bertentangan antara satu sama lain. Perbezaan utama antara penambahan oksidatif dan penghapusan reduktif ialah penambahan oksidatif merujuk kepada penambahan dua ligan anionik ke kompleks logam, sedangkan penghapusan reduktif merujuk kepada penyingkiran dua ligan anionik dari kompleks logam.
Rujukan:
1."10.1: Penambahan oksidatif dan penghapusan reduktif."Kimia Libretexts, Libretexts, 13 Okt. 2019, boleh didapati di sini.
2. "5.5: Penambahan oksidatif."Kimia Libreetexts, Libretexts, 5 Jun 2019, boleh didapati di sini.
3. "Penambahan oksidatif."Wikipedia, Yayasan Wikimedia, 9 Nov. 2019, boleh didapati di sini.
4. "Penghapusan Reduktif: Idea Umum."Kimia Libreetexts, Libretexts, 5 Jun 2019, boleh didapati di sini.
Ihsan gambar:
1. "OA Conserted" oleh Rifleman 82 (Talk) - Rifleman 82 (Talk) (Domain Awam) melalui Commons Wikimedia
2. "Sudut Bite Reductive Reductive" oleh Jgurak - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia