Perbezaan antara potensi pengoksidaan dan potensi pengurangan
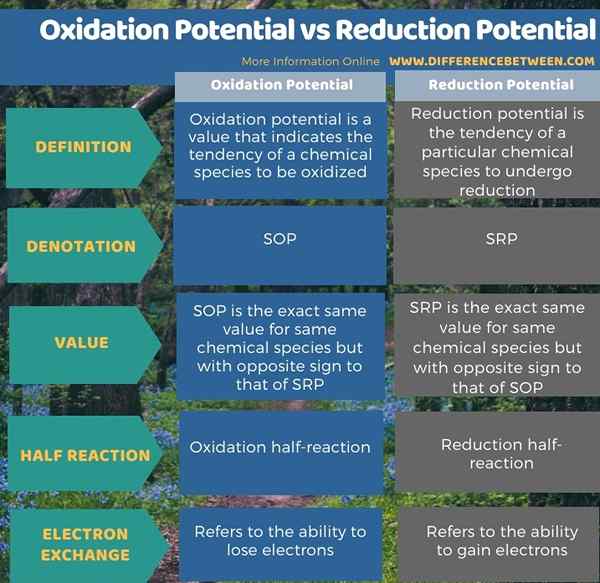
Perbezaan utama antara potensi pengoksidaan dan potensi pengurangan ialah Potensi pengoksidaan menunjukkan kecenderungan elemen kimia untuk dioksidakan. Sebaliknya, potensi pengurangan menunjukkan kecenderungan elemen kimia dikurangkan.
Potensi pengoksidaan dan potensi pengurangan adalah dua jenis nilai potensi elektrod untuk spesies kimia yang diberikan dalam voltan pada keadaan standard. Oleh itu, kami menamakan mereka potensi pengoksidaan standard dan potensi pengurangan standard. Nilai potensi ini menentukan keupayaan spesies kimia tertentu untuk menjalani pengoksidaan/pengurangan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah potensi pengoksidaan
3. Apakah potensi pengurangan
4. Perbandingan sampingan - potensi pengoksidaan vs potensi pengurangan dalam bentuk jadual
5. Ringkasan
Apakah potensi pengoksidaan?
Potensi pengoksidaan adalah nilai yang menunjukkan kecenderungan spesies kimia yang akan dioksidakan. Dengan kata lain, ia adalah keupayaan elektrod untuk kehilangan elektron (untuk mendapatkan teroksida). Biasanya, nilai ini diberikan pada keadaan standard; Oleh itu, kita harus menamakannya sebagai potensi pengoksidaan standard. Denotasi untuk istilah ini adalah SOP. Ia diukur dalam volt. Dan, ini sangat serupa dengan potensi pengurangan standard, tetapi mereka berbeza dengan tanda nilai, i.e. Nilai potensi pengoksidaan standard adalah nilai negatif potensi pengurangan standard. Kita boleh menulis potensi pengoksidaan sebagai tindak balas separuh. Formula umum untuk tindak balas pengoksidaan dan potensi pengoksidaan untuk tembaga diberikan di bawah:

Reaksi separuh pengoksidaan tembaga: CU(s) ⟶ cu2+ + 2e-
Nilai untuk potensi pengoksidaan standard untuk tindak balas di atas (pengoksidaan tembaga) ialah -0.34 v.
Apakah potensi pengurangan
Potensi pengurangan adalah kecenderungan spesies kimia tertentu untuk menjalani pengurangan. Maksudnya; Spesies kimia tertentu ini sanggup menerima elektron dari luar (untuk dikurangkan). Ia diukur dalam volt dan biasanya diukur di bawah keadaan standard. Oleh itu, kita boleh menamakannya sebagai potensi pengurangan standard. Denotasi untuk istilah ini adalah SRP. Kita boleh menulisnya dalam bentuk reaksi separuh pengurangan. Formula umum dan tembaga sebagai contoh diberikan di bawah:

Reaksi separuh pengurangan tembaga: CU2+ + 2e- ⟶ cu(s)
Nilai untuk potensi pengurangan standard untuk tindak balas di atas (pengurangan tembaga) adalah 0.34 V, yang merupakan nilai yang tepat, tetapi tanda bertentangan dari potensi pengoksidaan spesies kimia yang sama, tembaga. Oleh itu, kita boleh membangunkan hubungan antara pengoksidaan standard dan potensi pengurangan seperti berikut:
E00(Srp) = -e00(SOP)
Apakah perbezaan antara potensi pengoksidaan dan potensi pengurangan?
Potensi pengoksidaan dan potensi pengurangan adalah dua jenis nilai potensi elektrod untuk spesies kimia yang diberikan dalam voltan pada keadaan standard. Perbezaan utama antara potensi pengoksidaan dan potensi pengurangan adalah bahawa potensi pengoksidaan menunjukkan kecenderungan elemen kimia untuk dioksidakan, sedangkan potensi pengurangan menunjukkan kecenderungan unsur kimia dikurangkan. Oleh kerana nilai -nilai potensi ini diukur pada keadaan standard, kita harus menamakannya sebagai potensi pengoksidaan standard dan potensi pengurangan standard.
Selain itu, kami menunjukkan mereka sebagai SOP dan SRP. Tambahan pula, terdapat hubungan antara kedua -dua istilah ini; Potensi pengoksidaan standard adalah nilai yang sama tetapi dengan tanda yang berbeza dari potensi pengurangan standard.
Di bawah infographic meringkaskan perbezaan antara potensi pengoksidaan dan potensi pengurangan.

Ringkasan -potensi pengoksidaan vs potensi pengurangan
Potensi pengoksidaan dan potensi pengurangan adalah dua jenis nilai potensi elektrod untuk spesies kimia yang diberikan dalam voltan pada keadaan standard. Perbezaan utama antara potensi pengoksidaan dan potensi pengurangan adalah bahawa potensi pengoksidaan menunjukkan kecenderungan elemen kimia untuk dioksidakan, sedangkan potensi pengurangan menunjukkan kecenderungan unsur kimia dikurangkan.
Rujukan:
1. "Potensi pengurangan standard". Kimia Libreetexts, 2019, boleh didapati di sini.


