Perbezaan antara gambarajah orbital dan konfigurasi elektron
The Perbezaan utama Antara gambarajah orbital dan konfigurasi elektron ialah Gambar rajah orbital menunjukkan elektron dalam anak panah, menunjukkan putaran elektron. Tetapi, konfigurasi elektron tidak menunjukkan butiran mengenai putaran elektron.
Gambar rajah orbital menunjukkan susunan elektron yang diberikan oleh konfigurasi elektron. Konfigurasi elektron memberikan butiran mengenai pengedaran elektron di seluruh orbital atom. Tetapi, rajah orbital menunjukkan putaran elektron juga. Ini adalah perbezaan asas antara gambarajah orbital dan konfigurasi elektron.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah rajah orbital
3. Apakah konfigurasi elektron
4. Perbandingan sampingan - Rajah orbital vs konfigurasi elektron dalam bentuk jadual
6. Ringkasan
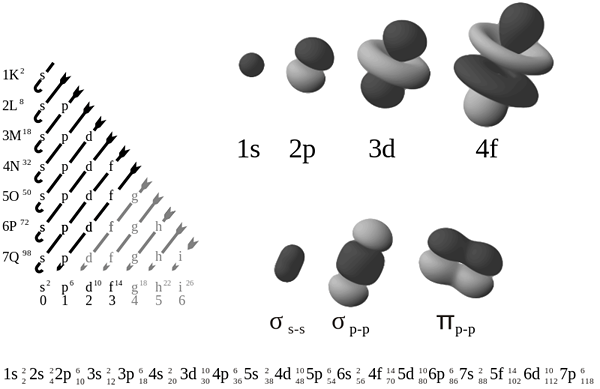
Apakah rajah orbital?
Gambar rajah orbital adalah sejenis gambarajah yang menunjukkan pengedaran elektron dalam orbital atom dan menunjukkan putaran elektron tersebut. Ia adalah sejenis notasi yang menunjukkan orbital mana yang diisi dan yang sebahagiannya diisi. Di sini, kami menggunakan anak panah untuk mewakili elektron. Arah anak panah (ke atas atau ke bawah) menunjukkan putaran elektron.
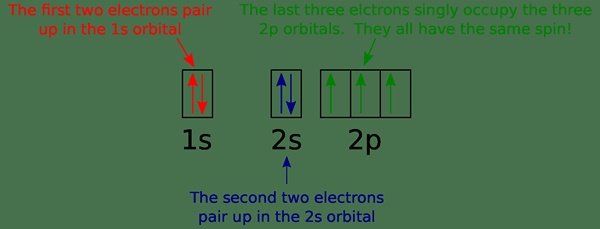
Rajah 01: Rajah orbital untuk nitrogen
Orbital boleh mempunyai maksimum dua elektron. Menurut Prinsip Pengecualian Pauli, dua elektron dalam atom yang sama tidak boleh mempunyai set nombor kuantum yang sama. Ini bermakna, walaupun semua nombor kuantum lain adalah sama, nombor kuantum spin berbeza. Dua elektron di orbital yang sama mempunyai putaran bertentangan. Imej di atas menunjukkan contoh gambarajah orbital.
Apakah konfigurasi elektron?
Konfigurasi elektron adalah cara mengatur elektron atom dengan menunjukkan pengedaran elektron tersebut di seluruh orbital. Terdahulu, konfigurasi elektron dibangunkan menggunakan model Bohr atom. Ini tepat untuk atom kecil dengan elektron yang lebih sedikit, tetapi apabila mempertimbangkan atom besar dengan sejumlah besar elektron, kita perlu menggunakan teori kuantum untuk penentuan pengedaran elektron.
Menurut mekanik kuantum, shell elektron adalah keadaan beberapa elektron yang berkongsi nombor kuantum utama yang sama, dan kami namakan shell menggunakan nombor yang diberikan untuk tahap tenaga dan jenis orbital yang kita sedang mempertimbangkan, e.g., 2s merujuk kepada orbital s shell elektron tahap tenaga ke -2. Selain itu, terdapat corak yang menerangkan bilangan maksimum elektron yang boleh mengandungi shell elektron. Di sini, nombor maksimum ini bergantung pada nombor kuantum azimut, l. Selanjutnya, nilai l = 0, 1, 2 dan 3 merujuk kepada orbital S, P, D dan F masing -masing. Jumlah maksimum elektron A shell boleh mengandungi = 2 (2l+1). Oleh itu, kita boleh membangunkan jadual berikut;
| Orbital | Bilangan maksimum elektron 2 (2L+1) |
| L = 0 adalah orbital s | 2 |
| L = 1 adalah p orbital | 6 |
| L = 2 adalah d orbital | 10 |
| L = 3 adalah f orbital | 14 |

Apabila mempertimbangkan notasi konfigurasi elektron, kita perlu menggunakan urutan nombor kuantum. Sebagai contoh, konfigurasi elektron untuk atom hidrogen adalah 1s1. Di sini, notasi ini mengatakan bahawa atom hidrogen mempunyai satu elektron di orbital s shell elektron pertama. Untuk fosforus, konfigurasi elektron adalah 1s22s22p63s23p3. Maksudnya; Atom fosfor mempunyai 3 cengkerang elektron yang dipenuhi dengan 15 elektron.
Apakah perbezaan antara gambarajah orbital dan konfigurasi elektron?
Gambar rajah orbital menunjukkan susunan elektron yang diberikan oleh konfigurasi elektron. Perbezaan utama antara gambarajah orbital dan konfigurasi elektron ialah gambarajah orbital menunjukkan elektron dalam anak panah yang menunjukkan putaran elektron. Sementara itu, konfigurasi elektron tidak menunjukkan butiran mengenai putaran elektron. Selain itu, dalam corak notasi, rajah orbital menggunakan anak panah untuk mewakili elektron, sementara konfigurasi elektron menunjukkan elektron menggunakan nombor.
Berikut adalah ringkasan perbezaan antara gambarajah orbital dan konfigurasi elektron.
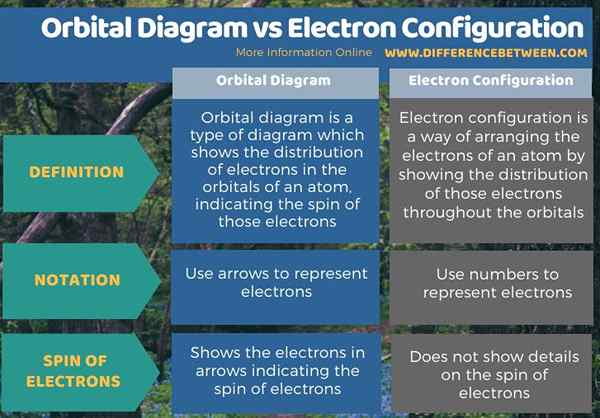
Ringkasan -Rajah orbital vs konfigurasi elektron
Perbezaan utama antara gambarajah orbital dan konfigurasi elektron ialah gambarajah orbital menunjukkan elektron dalam anak panah yang menunjukkan spin elektron, sedangkan konfigurasi elektron tidak menunjukkan butiran mengenai spin elektron.
Rujukan:
1. "1.4: Konfigurasi elektron dan rajah orbital."Kimia Libretexts, Libretexts, 26 Sept. 2019, boleh didapati di sini.
Ihsan gambar:
1. "Nitrogen Diagram Orbital" oleh Yayasan CK -12 (Raster), Adrignola (Vektor) - Fail: Kimia Sekolah Tinggi.PDF, Page 327 (Domain Awam) melalui Commons Wikimedia
2. "Orbital Elektron" oleh Patricia.FIDI - Kerja Sendiri oleh Patricia.Fidi dan Lt Paul - Asalnya dari Pl: Grafika: Orbite.PNG, Pengarang PL: Wikipedysta: Chemmix.Imej vektor yang tidak ditentukan oleh W3C ini dicipta dengan inkscape (domain awam) melalui Wikimedia Commons


