Perbezaan antara nitrit dan nitrogen dioksida
The Perbezaan utama antara nitrit dan nitrogen dioksida adalah bahawa Nitrite adalah anion manakala nitrogen dioksida adalah molekul.
Kedua -dua nitrit dan nitrogen dioksida mempunyai bilangan atom nitrogen dan oksigen yang sama; satu atom nitrogen dan dua atom oksigen. Malah struktur sebatian itu serupa. Tetapi, mereka berbeza antara satu sama lain mengikut caj elektrik yang mereka tahan terhadap mereka. Marilah kita membincangkan lebih banyak maklumat mengenai mereka.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu nitrit
3. Apa itu nitrogen dioksida
4. Perbandingan sampingan - Nitrite vs nitrogen dioksida dalam bentuk jadual
5. Ringkasan
Apa itu nitrit?
Nitrit adalah anion yang mempunyai formula kimia no-2. Sebatian ini mempunyai dua ikatan kimia kovalen dengan panjang ikatan yang sama. Selain itu, anion ini adalah ion simetri. Oleh itu, ia boleh menjalani pengoksidaan atau pengurangan sama ada. Akibatnya, ia boleh bertindak sebagai ejen pengurangan dan ejen pengoksidaan.

Rajah 01: Struktur ion nitrit
Jisim molar anion ini adalah 46.01 g/mol. Setelah protonasi, anion ini membentuk asid nitrous yang merupakan asid lemah yang tidak stabil. Anion ini juga boleh membentuk garam dan kompleks koordinasi. Selain itu, terdapat nitrit organik yang terdiri daripada ester asid nitrous.
Apa itu nitrogen dioksida?
Nitrogen dioksida adalah sebatian bukan organik yang mempunyai formula kimia no2. Selain itu, ia adalah sebatian neutral dengan caj elektrik sifar. Jisim molar sebatian ini ialah 46.05 g/mol. Ia berlaku sebagai gas yang muncul dalam warna oren. Walau bagaimanapun, ia mempunyai bau pedas seperti dalam gas klorin.

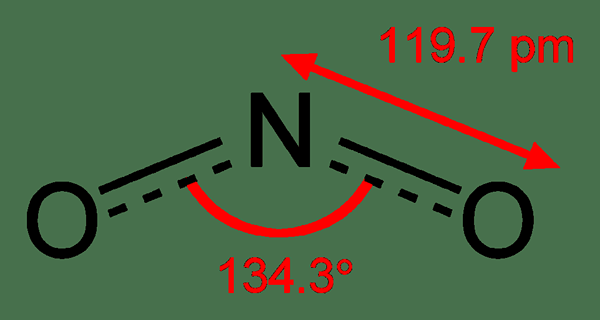
Rajah 02: Struktur kimia nitrogen dioksida
Selain itu, sebatian ini adalah paramagnetik. Panjang ikatan antara atom nitrogen dan atom oksigen adalah sama; Panjang ikatan setiap ikatan adalah 119.7 malam. Ia adalah ejen pengoksidaan yang kuat. Ia juga dapat menjalani pengurangan.
Apakah perbezaan antara nitrit dan nitrogen dioksida?
Nitrit adalah anion yang mempunyai formula kimia no-2. Ia adalah anion. Jisim molar anion ini adalah 46.01 g/mol. Atom nitrogen anion ini mempunyai keadaan pengoksidaan +3. Ia boleh membentuk garam, kompleks kordinasi atau berlaku di mineral. Sebaliknya, nitrogen dioksida adalah sebatian bukan organik yang mempunyai formula kimia NO2, dan ia adalah sebatian neutral yang mempunyai caj elektrik sifar. Jisim molar sebatian ini ialah 46.05 g/mol. Ia berlaku sebagai gas dengan penampilan warna oren. Selain itu, atom nitrogen molekul ini mempunyai keadaan pengoksidaan +4. Ini adalah perbezaan utama antara nitrit dan nitrogen dioksida.
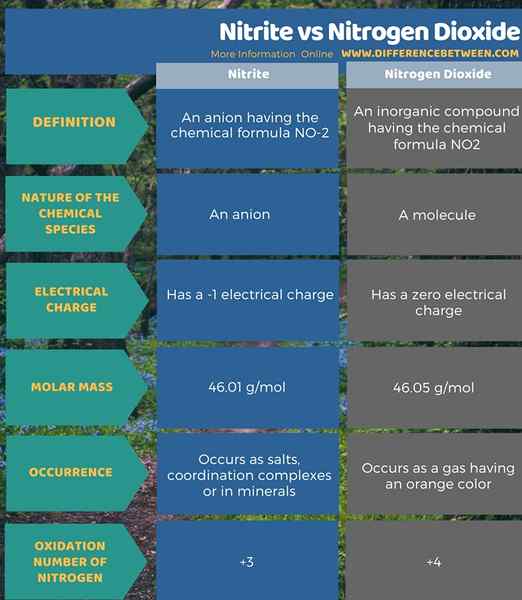
Ringkasan -Nitrite vs nitrogen dioksida
Kedua -dua nitrit dan nitrogen dioksida mempunyai formula molekul yang sama tetapi mereka mempunyai banyak perbezaan seperti yang dinyatakan di atas. Perbezaan utama antara nitrit dan nitrogen dioksida ialah nitrit adalah anion manakala nitrogen dioksida adalah molekul.
Rujukan:
1. "Nitrite."Wikipedia, Yayasan Wikimedia, 3 Julai 2018. Terdapat di sini
2. "Nitrogen dioksida."Wikipedia, Yayasan Wikimedia, 10 Julai 2018. Terdapat di sini
Ihsan gambar:
1.'Nitriteion-Resonance-Hybrid'by Yikrazuul-Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia
2.'Nitrogen-dioksida-2d-dimensi' Ben Mills-Kerja sendiri, (Domain Awam) melalui Commons Wikimedia


