Perbezaan antara persamaan Nernst dan persamaan Goldman
The Perbezaan utama Antara persamaan Nernst dan persamaan Goldman ialah Persamaan Nernst menerangkan hubungan antara potensi pengurangan dan potensi elektrod standard, sedangkan persamaan Goldman adalah terbitan persamaan Nernst dan menggambarkan potensi pembalikan di seluruh membran sel.
Sel elektrokimia adalah peranti elektrik yang dapat menjana elektrik menggunakan tenaga kimia tindak balas kimia. Atau kita boleh menggunakan peranti ini untuk membantu tindak balas kimia melalui menyediakan tenaga yang diperlukan dari elektrik. Potensi pengurangan sel elektrokimia menentukan keupayaan sel untuk menghasilkan elektrik.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah persamaan Nernst
3. Apa itu Persamaan Goldman
4. Perbandingan sampingan - Persamaan Nernst vs. Persamaan Goldman dalam bentuk jadual
5. Ringkasan
Apakah persamaan Nernst?
Persamaan Nernst adalah ungkapan matematik yang memberikan hubungan antara potensi pengurangan dan potensi pengurangan standard sel elektrokimia. Persamaannya dinamakan sempena saintis Walther Nernst. Dan, ia dibangunkan menggunakan faktor -faktor lain yang mempengaruhi tindak balas pengoksidaan dan pengurangan elektrokimia, seperti suhu dan aktiviti kimia spesies kimia yang menjalani pengoksidaan dan pengurangan.

Apabila memperoleh persamaan Nernst, kita perlu mempertimbangkan perubahan standard dalam tenaga bebas Gibbs yang dikaitkan dengan transformasi elektrokimia yang berlaku di dalam sel. Reaksi pengurangan sel elektrokimia boleh diberikan seperti berikut:
Lembu+ z e- ⟶ Merah
Menurut termodinamik, perubahan tenaga bebas sebenar reaksi adalah,
E = epengurangan - Epengoksidaan
Walau bagaimanapun, Gibbs Free Energy (ΔG) berkaitan dengan E (perbezaan berpotensi) seperti berikut:
ΔG = -nfe
Di mana n adalah bilangan elektron yang dipindahkan antara spesies kimia apabila reaksi sedang berjalan, f adalah pemalar faraday. Jika kita menganggap keadaan standard, maka persamaan adalah seperti berikut:
Δg0 = -Nfe0
Kita boleh mengaitkan tenaga bebas Gibbs keadaan yang tidak standard dengan tenaga Gibbs keadaan standard melalui persamaan berikut.
ΔG = ΔG0 + Rtlnq
Kemudian, kita dapat menggantikan persamaan di atas ke dalam persamaan standard ini untuk mendapatkan persamaan Nernst seperti berikut:
-nfe = -nfe0 + Rtlnq

Walau bagaimanapun, kita boleh menulis semula persamaan di atas menggunakan nilai untuk pemalar Faraday dan R (pemalar gas sejagat).
E = e0 - (0.0592vlnq/n)
Apa itu Persamaan Goldman?
Persamaan Goldman berguna dalam menentukan potensi terbalik di seluruh membran sel dalam fisiologi membran sel. Persamaan ini dinamakan sempena saintis David e. Goldman, yang membangunkan persamaan. Dan, ia diperoleh dari persamaan Nernst. Persamaan Goldman mengambil pengagihan ion yang tidak sekata di seluruh membran sel dan perbezaan dalam kebolehtelapan membran ke dalam akaun apabila menentukan potensi terbalik ini. Persamaan adalah seperti berikut:
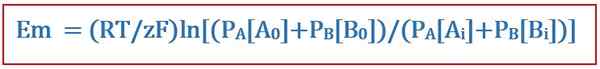
Di mana
- Em adalah perbezaan potensi di seluruh membran sel,
- R adalah pemalar gas sejagat,
- T adalah suhu termodinamik,
- Z adalah bilangan tahi lalat elektron yang dipindahkan antara spesies kimia,
- F adalah pemalar faraday,
- PA atau b adalah kebolehtelapan membran ke arah a atau b, dan
- [A atau B]i Adakah kepekatan ion A atau B di dalam membran sel.
Apakah perbezaan antara Persamaan Nernst dan Persamaan Goldman?
Persamaan Nernst dan Persamaan Goldman adalah ungkapan matematik yang boleh digunakan sebagai pengukuran potensi sel elektrokimia. Perbezaan utama antara persamaan Nernst dan persamaan Goldman ialah persamaan Nernst menerangkan hubungan antara potensi pengurangan dan potensi elektrod standard, sedangkan persamaan Goldman adalah terbitan persamaan Nernst dan menggambarkan potensi pembalikan di seluruh membran sel.
Infographic di bawah meringkaskan perbezaan antara persamaan Nernst dan persamaan Goldman.

Ringkasan -Persamaan Nernst vs Persamaan Goldman
Persamaan Nernst dan Persamaan Goldman adalah ungkapan matematik yang boleh digunakan sebagai pengukuran potensi sel elektrokimia. Perbezaan utama antara persamaan Nernst dan persamaan Goldman ialah persamaan Nernst menerangkan hubungan antara potensi pengurangan dan potensi elektrod standard, tetapi persamaan Goldman adalah terbitan persamaan Nernst dan menggambarkan potensi pembalikan di seluruh membran sel.
Rujukan:
1. "Persamaan Nernst."Kimia Libreetexts, Libretexts, 5 Jun 2019, boleh didapati di sini.
Ihsan gambar:
1. "Electrochemcell" oleh Alksub di Wikipedia Inggeris (CC BY-SA 3.0) melalui Commons Wikimedia


