Perbezaan antara kepelbagaian dan perintah bon
The Perbezaan utama antara kepelbagaian dan perintah bon ialah Multiplicity merujuk kepada bilangan orientasi yang mungkin dari spin tahap tenaga, sedangkan urutan bon merujuk kepada pengukuran bilangan elektron dalam ikatan kimia.
Kepelbagaian dan susunan bon adalah sifat sebatian kimia. Konsep kepelbagaian adalah penting dalam kimia kuantum, sementara konsep susunan bon adalah penting dalam dinamik molekul.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah kepelbagaian
3. Apa itu pesanan bon
4. Perbandingan sampingan - Multiplicity vs urutan ikatan dalam bentuk jadual
5. Ringkasan
Apakah kepelbagaian?
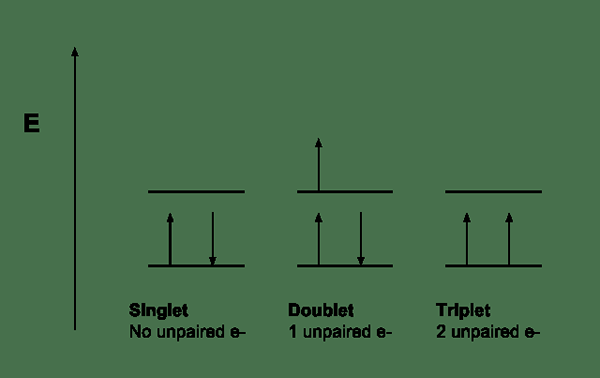
Multiplicity merujuk kepada bilangan orientasi yang mungkin berputar tahap tenaga. Konsep ini berguna dalam mekanik spektroskopi dan kuantum. Persamaan untuk pengukuran kepelbagaian adalah 2s+1 di mana "s" merujuk kepada jumlah momentum sudut putaran. Nilai -nilai yang dapat kita perolehi untuk kepelbagaian termasuk 1, 2, 3, 4 ... kita boleh menamakannya sebagai singlet, doublet, tiga, kuartet, dll.

Kepelbagaian diukur berbanding dengan momentum sudut orbital. Maksudnya; Ia diukur berbanding dengan bilangan tahap tenaga yang hampir merosot, yang berbeza antara satu sama lain mengikut tenaga interaksi spin-orbit. Sebagai contoh, sebatian organik yang stabil mempunyai cengkerang elektron lengkap yang tidak mempunyai elektron yang tidak berpasangan. Oleh itu, molekul ini mempunyai singlet, keadaan tanah.
Apa itu pesanan bon?
Pesanan bon merujuk kepada pengukuran bilangan elektron dalam ikatan kimia. Konsep perintah bon telah dibangunkan oleh Linus Pauling. Ia berguna sebagai penunjuk kestabilan ikatan kimia. Lebih tinggi nilai pesanan bon, lebih kuat ikatan kimia. Sekiranya tidak ada orbital antibonda, perintah bon sama dengan bilangan ikatan antara dua atom molekul. Ini kerana perintah bon kemudiannya sama dengan bilangan elektron ikatan yang dibahagikan dengan dua (bon kimia mempunyai dua elektron setiap ikatan). Persamaan untuk pengiraan perintah bon dalam molekul tertentu adalah seperti berikut:
Pesanan bon = (bilangan elektron ikatan - bilangan elektron antibond)/2
Menurut persamaan di atas, jika perintah bon adalah sifar, kedua -dua atom tidak terikat antara satu sama lain. Contohnya, perintah bon untuk molekul dinitrogen ialah 3. Selain itu, spesies isoelektronik biasanya mempunyai perintah bon yang sama. Selain itu, konsep susunan bon berguna dalam dinamik molekul dan potensi pesanan bon.
Apakah perbezaan antara kepelbagaian dan perintah bon?
Konsep kepelbagaian adalah penting dalam kimia kuantum, sementara konsep susunan bon adalah penting dalam dinamik molekul. Perbezaan utama antara kepelbagaian dan perintah bon adalah bahawa kepelbagaian merujuk kepada bilangan orientasi yang mungkin dari spin tahap tenaga, sedangkan urutan bon merujuk kepada pengukuran bilangan elektron dalam ikatan kimia.
Persamaan untuk penentuan kepelbagaian adalah 2s+1 di mana s adalah jumlah momentum sudut putaran. Persamaan untuk penentuan perintah bon adalah (elektron ikatan + elektron antibonda)/2. Selain itu, kepelbagaian diukur sebagai nilai relatif (yang relatif terhadap momentum sudut orbital). Tetapi, perintah bon adalah nilai tertentu untuk ikatan kimia tertentu. Biasanya, jika perintah bon adalah sifar, ini bermaksud tidak ada ikatan kimia.
Di bawah infographic meringkaskan perbezaan antara kepelbagaian dan perintah bon.
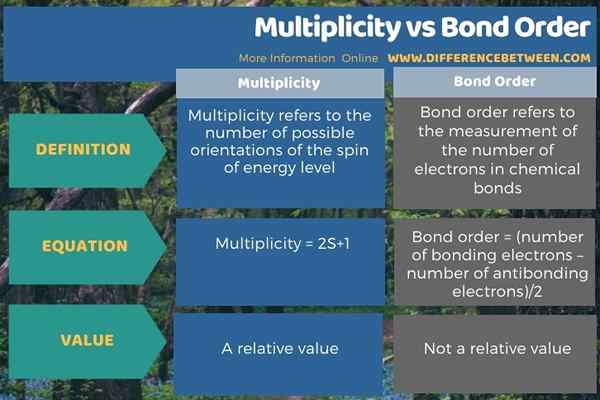
Ringkasan -Multiplicity vs urutan bon
Konsep kepelbagaian adalah penting dalam kimia kuantum, sementara konsep susunan bon adalah penting dalam dinamik molekul. Perbezaan utama antara kepelbagaian dan perintah bon adalah bahawa kepelbagaian merujuk kepada bilangan orientasi yang mungkin dari spin tahap tenaga manakala urutan bon merujuk kepada pengukuran bilangan elektron dalam ikatan kimia.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi dan contoh pesanan bon."Thoughtco, Nov. 5, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Gambarajah Multiplicity Spin" oleh LILLILEX - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


