Perbezaan antara pepejal rangkaian pepejal dan kovalen molekul
The Perbezaan utama antara pepejal rangkaian pepejal dan kovalen molekul ialah bentuk pepejal molekul disebabkan oleh tindakan daya van der waal manakala bentuk pepejal rangkaian kovalen disebabkan oleh tindakan ikatan kimia kovalen.
Kita boleh mengkategorikan sebatian pepejal dengan cara yang berbeza - bergantung kepada struktur, komposisi, ikatan, sifat, aplikasi, dll. Pepejal molekul, pepejal ionik, pepejal logam, pepejal rangkaian kovalen adalah pelbagai jenis pepejal.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah pepejal molekul
3. Apa itu Pepejal Rangkaian Kovalen
4. Perbandingan sampingan - Pepejal kovalen pepejal molekul pepejal dalam bentuk jadual
5. Ringkasan
Apakah pepejal molekul?
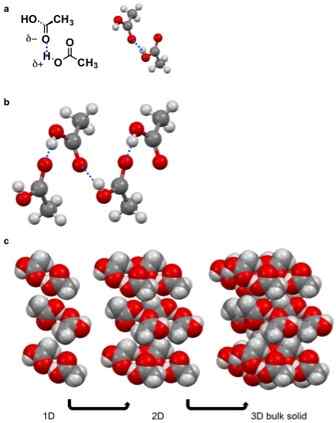
Pepejal molekul adalah sebatian pepejal yang mengandungi molekul yang dipegang bersama melalui kuasa van der waal. Tidak ada ikatan ionik atau kovalen antara molekul ini. Kekuatan antara molekul ini adalah daya tarikan yang kohesif. Terdapat pelbagai jenis daya van der waal yang boleh menyebabkan pembentukan pepejal molekul, i.e. interaksi dipole-dipole, interaksi pi-pi, ikatan hidrogen, pasukan London, dll.

Rajah 01: Pembentukan pepejal molekul disebabkan oleh ikatan hidrogen
Walau bagaimanapun, daya van der waal ini lebih lemah berbanding dengan ikatan kimia ionik dan kovalen. Oleh itu, pepejal molekul biasanya mempunyai titik lebur dan mendidih yang agak rendah. Selain itu, pepejal ini cenderung membubarkan pelarut organik. Pepejal molekul ini mempunyai ketumpatan yang rendah dan juga tidak konduktif; Oleh itu, ini adalah penebat elektrik lembut.

Rajah 02: Karbon dioksida pepejal dan kafein pepejal adalah pepejal molekul
Lebih -lebih lagi, apabila mempertimbangkan allotropes yang berbeza dari elemen kimia, semua allotropes kadang -kadang wujud sebagai pepejal molekul, tetapi kebanyakan masa, beberapa allotropes adalah pepejal molekul manakala allotropes lain dari unsur kimia yang sama bukan pepejal molekul. Sebagai contoh, terdapat bentuk fosforus allotropik yang berbeza; Kami namakan mereka sebagai fosforus merah, putih dan hitam. Antaranya, fosforus putih adalah pepejal molekul, tetapi fosforus merah wujud sebagai struktur rantai.
Tambahan pula, pepejal molekul sama ada mulur atau rapuh bergantung kepada sifat wajah kristal pepejal. Kedua -dua bentuk mulur dan rapuh ini dapat mengalami ubah bentuk elastik juga.
Apakah pepejal rangkaian kovalen?
Pepejal rangkaian kovalen adalah sebatian pepejal yang mengandungi atom yang terikat antara satu sama lain melalui ikatan kimia kovalen. Pepejal ini mempunyai sejumlah atom berulang yang dikaitkan antara satu sama lain melalui ikatan kovalen. Ikatan kimia boleh menyebabkan pembentukan rangkaian atom, yang membawa kepada pembentukan pepejal rangkaian. Oleh itu, kita boleh mempertimbangkan pepejal rangkaian kovalen sebagai sejenis makromolekul.
Tambahan pula, pepejal ini boleh berlaku dalam dua cara; sebagai pepejal kristal atau pepejal amorf. Contoh yang sesuai untuk pepejal rangkaian adalah berlian dengan atom karbon terikat kovalen, yang membentuk struktur 3D yang kuat. Biasanya, pepejal rangkaian kovalen mempunyai titik lebur dan mendidih yang agak tinggi. Umumnya, pepejal ini tidak larut dalam sebarang jenis pelarut kerana sangat sukar untuk memecahkan ikatan antara atom. Selain itu, pepejal ini sangat sukar dan mempunyai kekonduksian elektrik yang rendah pada fasa cairnya. Kekonduksian elektrik pada fasa pepejal mungkin berbeza mengikut komposisi.
Apakah perbezaan antara pepejal rangkaian pepejal dan kovalen molekul?
Pepejal molekul dan pepejal rangkaian kovalen adalah dua jenis sebatian pepejal. Perbezaan utama antara pepejal rangkaian pepejal dan kovalen molekul ialah bentuk pepejal molekul yang disebabkan oleh tindakan daya van der waal manakala bentuk kovalen kovalen disebabkan oleh tindakan ikatan kimia kovalen. Apabila mempertimbangkan sifat mereka, pepejal molekul adalah bahan yang agak lembut, sementara pepejal rangkaian kovalen sangat sukar.
Selain itu, pepejal molekul mempunyai titik lebur yang agak rendah, manakala pepejal rangkaian kovalen mempunyai titik lebur yang sangat tinggi. Tambahan pula, pepejal molekul adalah penebat elektrik, manakala pepejal rangkaian kovalen mempunyai kekonduksian elektrik yang rendah pada keadaan cecair dan kekonduksian elektrik pada fasa pepejal mungkin berbeza mengikut komposisi. Air ais adalah contoh yang baik untuk pepejal molekul, sementara Diamond adalah contoh terbaik dari kovalen rangkaian pepejal.
Di bawah infographic meringkaskan perbezaan antara pepejal rangkaian pepejal dan kovalen molekul.
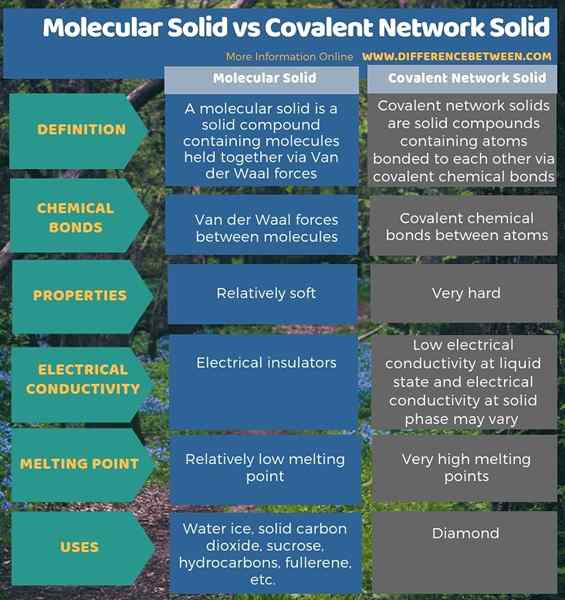
Ringkasan -pepejal kovalen pepejal molekul pepejal
Pepejal molekul dan pepejal rangkaian kovalen adalah dua jenis sebatian pepejal. Perbezaan utama antara pepejal rangkaian pepejal dan kovalen molekul ialah bentuk pepejal molekul yang disebabkan oleh tindakan daya van der waal manakala bentuk kovalen kovalen disebabkan oleh tindakan ikatan kimia kovalen.
Rujukan:
1. Helmenstine, Anne Marie. "Pepejal Molekul: Definisi dan Contoh."Thoughtco, dec. 3, 2018, boleh didapati di sini.
2. Helmenstine, Anne Marie. "Definisi kukuh rangkaian dalam kimia."Thoughtco, Jul. 8, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Ikatan hidrogen asid asetik" oleh Cryst Eng 340 - Kerja sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Karbon Dioksida dan Kafein" oleh Cryst Eng 340 - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


