Perbezaan antara isotop dan isomer

Isotop vs isomer
Terdapat variasi antara atom yang berbeza. Juga, terdapat variasi dalam elemen yang sama. Isotop adalah contoh untuk perbezaan dalam satu elemen.
Molekul atau ion yang mempunyai formula molekul yang sama boleh wujud dengan cara yang berbeza bergantung kepada perintah ikatan, perbezaan pengagihan caj, cara mereka mengatur diri mereka di ruang dan lain -lain; Ini dikenali sebagai isomer.
Isotop
Atom elemen yang sama boleh berbeza. Atom yang berbeza dari elemen yang sama dipanggil isotop. Mereka berbeza antara satu sama lain dengan mempunyai bilangan neutron yang berbeza. Oleh kerana nombor neutron berbeza, nombor jisim mereka juga berbeza. Walau bagaimanapun, isotop elemen yang sama mempunyai bilangan proton dan neutron yang sama. Isotop yang berbeza hadir dalam kuantiti yang berbeza -beza, dan ini diberikan sebagai nilai peratusan yang disebut kelimpahan relatif. Sebagai contoh, hidrogen mempunyai tiga isotop sebagai protium, deuterium dan tritium. Bilangan neutron dan kelimpahan relatif mereka adalah seperti berikut.
1H - Tiada neutron, kelimpahan relatif adalah 99.985%
2H- satu neutron, kelimpahan relatif adalah 0.015%
3H- Dua neutron, kelimpahan relatif adalah 0%
Bilangan neutron yang boleh dipegang nukleus berbeza dari elemen ke elemen. Di antara isotop ini, hanya ada yang stabil. Contohnya, oksigen mempunyai tiga isotop stabil, dan timah mempunyai sepuluh isotop stabil. Kebanyakan masa, elemen mudah mempunyai nombor neutron yang sama seperti nombor proton tetapi, dalam unsur -unsur berat, lebih banyak neutron ada daripada proton. Bilangan neutron adalah penting untuk mengimbangi kestabilan nukleus. Apabila nukleus terlalu berat, mereka menjadi tidak stabil dan, oleh itu, isotop menjadi radioaktif. Sebagai contoh, 238 U memancarkan radiasi dan mereput ke nukleus yang lebih kecil. Isotop mungkin mempunyai sifat yang berbeza kerana orang ramai yang berbeza. Sebagai contoh, mereka mungkin mempunyai putaran yang berbeza, oleh itu spektrum NMR mereka berbeza. Walau bagaimanapun, bilangan elektron mereka adalah sama menimbulkan tingkah laku kimia yang sama.
Spektrometer massa boleh digunakan untuk mendapatkan maklumat mengenai isotop. Ia memberikan bilangan isotop yang mempunyai elemen, banyaknya relatif dan massa.
Isomer
Isomer adalah sebatian yang berbeza dengan formula molekul yang sama. Terdapat pelbagai jenis isomer. Isomer boleh dibahagikan kepada dua kumpulan sebagai isomer perlembagaan dan isomer stereo. Isomer perlembagaan adalah isomer di mana sambungan atom berbeza dalam molekul. Butane adalah alkana yang paling mudah untuk menunjukkan isomerisme perlembagaan. Butane mempunyai dua isomer perlembagaan, butana sendiri dan isobutene.
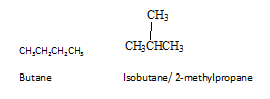
Dalam atom stereo-isomer disambungkan dalam urutan yang sama, tidak seperti isomer perlembagaan. Stereoisomer hanya berbeza dalam susunan atom mereka di ruang angkasa. Stereoisomer boleh terdiri daripada dua jenis, enantiomer dan diastereomer. Diastereomers adalah stereoisomer yang molekulnya bukan imej cermin antara satu sama lain. Isomer trans cis dari 1,2-dichloroethene adalah diastereomers. Enantiomer adalah stereoisomer yang molekulnya adalah imej cermin yang tidak dapat ditemui antara satu sama lain. Enantiomer hanya berlaku dengan molekul kiral. Molekul kiral ditakrifkan sebagai salah satu yang tidak sama dengan imej cerminnya. Oleh itu, molekul kiral dan imej cerminnya adalah enantiomer antara satu sama lain. Sebagai contoh, molekul 2-butanol adalah kiral, dan imej cerminnya adalah enantiomer.
| Apakah perbezaan antara Isotop dan isomer? • isotop adalah atom yang berbeza dari elemen yang sama. Isomer adalah sebatian yang berbeza dengan formula molekul yang sama. • Isotop berbeza antara satu sama lain kerana bilangan neutron, sedangkan isomer berbeza antara satu sama lain kerana susunan atom. • Isotop satu elemen mempunyai tingkah laku kimia yang sama, tetapi sifat fizikal mungkin berbeza. Isomer dengan formula kimia yang sama mempunyai perbezaan dalam kedua -dua sifat kimia dan fizikal (kecuali beberapa isomer). |


