Perbezaan antara isotop dan isobar dan isoton
Perbezaan utama - Isotop vs Isobar vs isoton
Isotop adalah atom elemen kimia yang sama yang mempunyai bilangan neutron yang berlainan. Oleh itu isotop elemen kimia yang sama mempunyai nombor atom yang sama tetapi jisim atom yang berbeza. Isobar adalah atom elemen kimia yang berbeza. Oleh itu nombor atom pada dasarnya berbeza antara satu sama lain. Isoton mempunyai bilangan neutron yang sama dalam nukleus atom mereka. The Perbezaan utama antara isotop, isobar dan isoton adalah bahawa isotop adalah atom dengan bilangan proton yang sama, tetapi bilangan neutron dan isobar yang berbeza adalah atom unsur -unsur kimia yang berbeza yang mempunyai nilai yang sama untuk jisim atom manakala isoton adalah atom unsur -unsur kimia yang berbeza yang mempunyai bilangan neutron yang sama dalam nukleus atom.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu isotop
3. Apa itu Isobars
4. Apa itu isoton
5. Perbandingan sampingan - isotop vs isobars vs isoton dalam bentuk jadual
6. Ringkasan
Apa itu isotop?
Isotop adalah atom dengan bilangan proton yang sama, tetapi bilangan neutron yang berbeza. Sejumlah proton dalam atom adalah bilangan atom atom itu. Unsur kimia tertentu mempunyai bilangan proton tetap. Oleh itu, bilangan atom atom elemen kimia yang sama sama antara satu sama lain. Oleh itu, isotop adalah atom elemen kimia yang sama. Jumlah proton dan neutron dikenali sebagai jisim atom. Isotop mempunyai jisim atom yang berbeza.
Tingkah laku kimia isotop elemen kimia adalah sama, tetapi sifat fizikal berbeza antara satu sama lain. Hampir semua elemen kimia mempunyai isotop. Terdapat 275 isotop yang diketahui 81 elemen kimia yang stabil. Untuk elemen kimia tertentu, terdapat isotop stabil serta isotop radioaktif (tidak stabil).

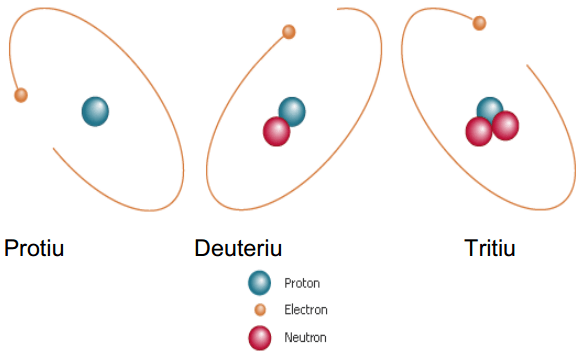
Rajah 01: Isotop hidrogen
Isotop dinamakan menggunakan nama elemen kimia dan jisim atom isotop. Sebagai contoh, kedua-dua isotop helium diperhatikan sebagai "helium-2" dan "helium-4". Beberapa contoh isotop diberikan di bawah.

Apa itu Isobars?
Isobar adalah atom elemen kimia yang berbeza yang mempunyai nilai yang sama untuk jisim atom. Jisim atom adalah jumlah proton dan neutron dalam nukleus atom. Proton atau neutron dikenali sebagai nukleon. Oleh itu, isobar mempunyai bilangan nukleon yang sama.
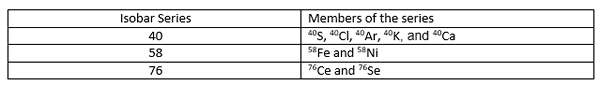
Nombor atom isobar ini berbeza antara satu sama lain kerana unsur -unsur kimia yang berbeza mempunyai bilangan atom yang berbeza. Peraturan Isobar Matauch menyatakan bahawa jika dua elemen bersebelahan pada jadual berkala mempunyai isotop bilangan jisim yang sama (isobars), salah satu isotop ini mestilah radioaktif. Sekiranya terdapat isobar dari tiga elemen berurutan, isobar pertama dan terakhir stabil, dan pertengahan mungkin mengalami kerosakan radioaktif. Siri Isobar adalah koleksi isotop yang berbeza yang mempunyai jisim atom yang sama.
Apa itu isoton?
Isoton adalah atom unsur yang berbeza yang mempunyai bilangan neutron yang sama dalam nukleus atom. Isoton mempunyai bilangan atom yang berbeza (bilangan proton dalam nukleus berbeza antara satu sama lain) serta jisim atom yang berbeza. Ia boleh dinyatakan seperti di bawah;
Nombor atom = z
Jisim atom = a
Bilangan neutron = n
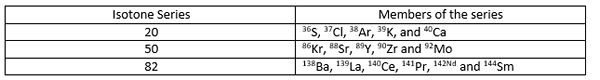
Untuk semua isoton dalam satu siri, ≠ z tetapi (a-z) = n (n adalah sama untuk semua isoton dalam satu siri). Beberapa contoh untuk isoton diberikan di bawah.
Apakah perbezaan antara isotop dan isobar dan isoton?
Isotop vs isobars vs isotones | |
| Isotop | Isotop adalah atom dengan bilangan proton yang sama, tetapi bilangan neutron yang berbeza. |
| Isobar | Isobar adalah atom elemen kimia yang berbeza yang mempunyai nilai yang sama untuk jisim atom. |
| Isoton | Isoton adalah atom unsur yang berbeza yang mempunyai bilangan neutron yang sama dalam nukleus atom. |
| Nombor atom | |
| Isotop | Isotop mempunyai nombor atom yang sama. |
| Isobar | Isobar mempunyai nombor atom yang berbeza. |
| Isoton | Isoton mempunyai nombor atom yang berbeza. |
| Jisim atom | |
| Isotop | Isotop mempunyai jisim atom yang berbeza. |
| Isobar | Isobar mempunyai jisim atom yang sama. |
| Isoton | Isoton mempunyai jisim atom yang berbeza. |
| Bilangan neutron | |
| Isotop | Isotop mempunyai bilangan neutron yang berbeza. |
| Isobar | Isobar mempunyai bilangan neutron yang berbeza. |
| Isoton | Isoton bilangan neutron yang sama. |
Ringkasan - Isotop vs Isobar vs isoton
Isotop, isobar dan isoton adalah istilah yang digunakan untuk menggambarkan hubungan antara atom unsur kimia yang berbeza. Perbezaan antara isotop, isobar dan isoton adalah bahawa isotop adalah atom dengan bilangan proton yang sama, tetapi bilangan neutron dan isobar yang berbeza adalah atom -atom unsur -unsur kimia yang berbeza yang mempunyai nilai yang sama untuk jisim atom manakala isoton adalah atom unsur -unsur yang berbeza yang mempunyai bilangan yang sama neutron dalam nukleus atom.
Rujukan:
1.Helmenstine, Anne Marie, D. "Definisi dan contoh isotop dalam kimia."Thoughtco, Aug. 4 2017. Terdapat di sini
2.Editor Encyclopædia Britannica. "Isoton."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 20 Julai 1998. Terdapat di sini
3."Isobar (nukleus)."Wikipedia, Yayasan Wikimedia, 27 Dis. 2017. Terdapat di sini
4.Herzog, Gregory F. "Isotop."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 6 dec. 2017. Terdapat di sini
Ihsan gambar:
1.'Izotopii Hidrogenului'by Nicolae Coman - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia


