Perbezaan antara isotonik dan hipertonik
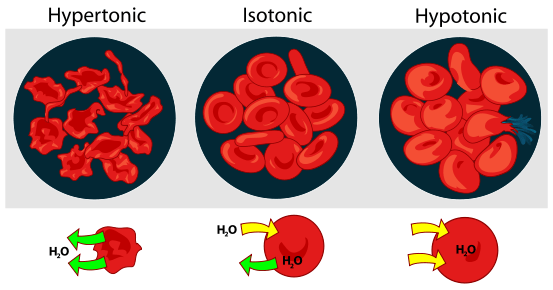
Perbezaan utama - isotonik vs hipertonik
Penting untuk memahami konsep tonik sebelum menganalisis perbezaan antara isotonik dan hipertonik. Oleh itu, marilah kita terlebih dahulu menerangkan secara ringkas konsep tonik dan kepentingannya. Tonicity adalah varians dalam kepekatan air dua penyelesaian yang dibahagikan dengan membran semipermeable. Ia juga dapat dijelaskan sebagai kepekatan penyelesaian air relatif yang menentukan arah dan jumlah penyebaran air sehingga mencapai kepekatan yang sama di kedua -dua belah membran. Dengan mengenal pasti tonik penyelesaian, kita dapat menentukan di mana arah air akan meresap. Fenomena ini biasanya digunakan apabila menggambarkan tindak balas sel yang direndam dalam penyelesaian luaran. Terdapat tiga klasifikasi tonik yang satu penyelesaian boleh mempunyai relatif kepada yang lain.Mereka adalah hipertonik, hipotonik, dan isotonik. The Perbezaan utama antara isotonik dan hipertonik adalah Penyelesaian hipertonik mengandungi lebih banyak pelarut daripada larut sedangkan pelarut dan pelarut sama -sama diedarkan dalam larutan isotonik. Walau bagaimanapun, menghafal definisi penyelesaian hipertonik dan isotonik tidak penting jika kita dapat memahami perbezaan antara penyelesaian isotonik dan hipertonik.
Apa itu hipertonik?
Hyper adalah perkataan lain untuk di atas atau berlebihan. Penyelesaian hipertonik akan mempunyai kepekatan larutan (glukosa atau garam) yang lebih tinggi daripada sel. Larutan adalah unsur -unsur yang dibubarkan dalam pelarut, dengan itu membentuk penyelesaian. Dalam larutan hipertonik, kepekatan larutan lebih besar di luar sel daripada di dalamnya. Apabila sel direndam dalam larutan hipertonik akan ada peralihan osmotik dan molekul air akan mengalir keluar dari sel untuk mengimbangi kepekatan larutan dan akan ada pengecutan dalam saiz sel.
Apa itu Isotonik?
ISO adalah perkataan lain untuk sama dan tonik adalah untuk tonik penyelesaiannya. Penyelesaian isotonik akan mempunyai kepekatan larut yang sama daripada penyelesaian yang dibandingkan dengan. Dalam larutan isotonik, kepekatan larutan adalah sama di dalam dan di luar sel yang mewujudkan keseimbangan dalam persekitaran organisasi selular. Apabila sel direndam dalam larutan isotonik, tidak akan ada peralihan osmotik dan molekul air meresap melalui membran sel di kedua -dua arah untuk mengimbangi kepekatan larutan. Proses ini tidak akan menghasilkan bengkak atau mengecut sel.
Apakah perbezaan antara isotonik dan hipertonik?
Perbezaan antara hipertonik dan isotonik dapat diklasifikasikan ke dalam kategori berikut.
Definisi Isotonik dan hipertonik
Hypertonic: "Hyper" dikenali sebagai di atas atau berlebihan + "tonik" dikenali sebagai sesuatu di sepanjang garis penyelesaian. Oleh itu, hipertonik mencadangkan peningkatan tonik penyelesaian.
Isotonik: "ISO" dikenali sebagai sama + "tonik" dikenali sebagai sesuatu di sepanjang garis penyelesaian. Oleh itu, isotonik mencadangkan tonik yang serupa dengan penyelesaiannya.
Ciri-ciri Isotonik dan hipertonik
Kepekatan larut dan larutan
Hypertonic: Penyelesaian mengandungi lebih banyak pelarut daripada larut.
Isotonik: Larut dan pelarut dalam larutan diedarkan dengan cara yang sama.
Contoh
Hypertonic: Air yang disucikan, kerana tidak ada/kurang larutan dibubarkan dalam air yang disucikan, dan kepekatannya sangat rendah berbanding dengan persekitaran selular.
Isotonik: Penyelesaian garam adalah isotonik kepada plasma darah manusia
Respons sel dalam penyelesaian hipertonik dan isotonik (Lihat Rajah 1)
Hypertonic: Apabila sel biologi berada dalam persekitaran hipertonik, air mengalir di seluruh membran sel keluar dari sel, untuk mengimbangi kepekatan larutan di kedua -dua sel dan persekitaran di sekitar sel. Akibatnya, Sel akan mengecut Apabila air meninggalkan sel untuk mengurangkan kepekatan larutan yang lebih tinggi di persekitaran luar.
Isotonik: Apabila sel berada dalam larutan isotonik, ia tidak akan menghasilkan bengkak atau mengecut sel.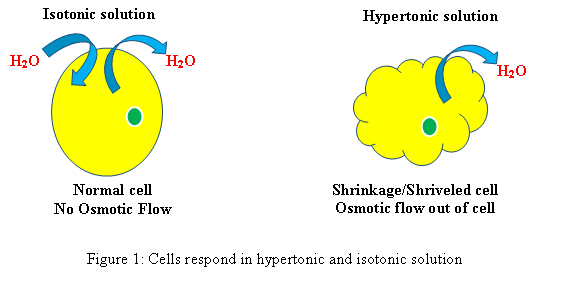
Kecerunan kepekatan air
Hypertonic: Kecerunan kepekatan air dapat dilihat dari bahagian dalam sel ke penyelesaian hipertonik
Isotonik: Kecerunan kepekatan air tidak wujud
Kecerunan kepekatan larut
Hypertonic: Kecerunan kepekatan larut dilihat dari penyelesaian hipertonik ke dalam sel
Isotonik: Kecerunan konsentrasi larut tidak wujud.
Peralihan osmotik
Hypertonic: Peralihan osmotik wujud.
Isotonik: Peralihan osmotik tidak wujud
Pergerakan air
Hypertonic: Molekul air bergerak atau meresap dengan cepat dari dalam sel ke arah penyelesaian luar, dan oleh itu sel akan kehilangan air.
Isotonik: Molekul air bergerak atau meresap ke kedua -dua arah, dan kadar penyebaran air adalah serupa di setiap arah. Oleh itu, sel akan memperoleh atau kehilangan air.
Minuman sukan
Isotonik: Minuman isotonik terdiri daripada kepekatan garam, karbohidrat gula dan elektrolit yang serupa seperti dalam tubuh manusia. Minuman sukan isotonik sering disukai sebagai penyelesaian rehidrasi lisan. Biasanya mempunyai 4-8g karbohidrat setiap 100 ml.
Hypertonic: Minuman hipertonik terdiri daripada kepekatan garam, karbohidrat gula dan elektrolit yang lebih tinggi seperti dalam tubuh manusia. Biasanya mempunyai kira -kira 8g karbohidrat setiap 100 ml. Penyelesaian hipertonik juga digunakan dalam osmotherapy untuk menguruskan pendarahan serebrum. Minuman sukan hipertonik sesuai untuk mereka yang memerlukan tenaga yang sangat tinggi.
Kesimpulannya, terdapat tiga bentuk penyelesaian yang berdasarkan kepekatan larut dan mereka adalah isotonik, hipotonik, dan hipertonik. Kepekatan larutan adalah sama di dalam dan di luar sel dalam larutan isotonik. Kepekatan larutan lebih besar di dalam sel daripada persekitaran luar dalam larutan hipotonik manakala larutan hipertonik adalah satu di mana kepekatan larutan lebih besar di luar persekitaran daripada sel dalam.
Rujukan Mansoor, m. A., Beverly, j., dan Sandmann. (2002). Farmasi fizikal yang digunakan. McGraw-Hill Professional. ms. 54-57. Voet, d., Judith, g. V. dan Charlotte, w. P. (2001). Asas Biokimia (REV.ed.). New York: Wiley. p.30. Ihsan imej: "Tekanan osmotik pada rajah sel darah" oleh Ladyofhats - adakah saya sendiri berdasarkan [1], [2], [3] dan [4] ... (domain awam) melalui Wikimedia Commons


