Perbezaan antara ikatan ionik dan ikatan logam
The Perbezaan utama antara ikatan ionik dan ikatan logam ialah Ikatan ionik berlaku antara ion positif dan negatif manakala ikatan logam berlaku antara ion positif dan elektron.
Sebagai ahli kimia Amerika g.N.Lewis mencadangkan, atom stabil apabila mereka mengandungi lapan elektron dalam shell valence mereka. Kebanyakan atom mempunyai kurang daripada lapan elektron dalam kerang valensi mereka (kecuali gas mulia dalam kumpulan 18 jadual berkala); Oleh itu, mereka tidak stabil. Atom -atom ini cenderung bertindak balas antara satu sama lain untuk menjadi stabil. Oleh itu, setiap atom dapat mencapai konfigurasi elektronik gas mulia. Ini berlaku dengan membentuk ikatan ionik, ikatan kovalen atau ikatan logam.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah ikatan ionik
3. Apakah ikatan logam
4. Perbandingan sampingan - ikatan ionik vs ikatan logam dalam bentuk jadual
5. Ringkasan
Apakah ikatan ionik?
Atom dapat memperoleh atau kehilangan elektron dan membentuk zarah yang negatif atau positif. Zarah -zarah ini adalah "ion". Terdapat interaksi elektrostatik antara ion -ion ini. Sehubungan itu, ikatan ionik adalah daya tarikan antara ion -ion yang bertentangan ini.
Elektronegativiti atom dalam ikatan ionik mempengaruhi kekuatan interaksi elektrostatik. Oleh itu, elektronegativiti memberikan pengukuran pertalian atom untuk elektron. Atom dengan elektronegativiti yang tinggi dapat menarik elektron dari atom dengan elektronegativiti yang rendah untuk membentuk ikatan ionik.
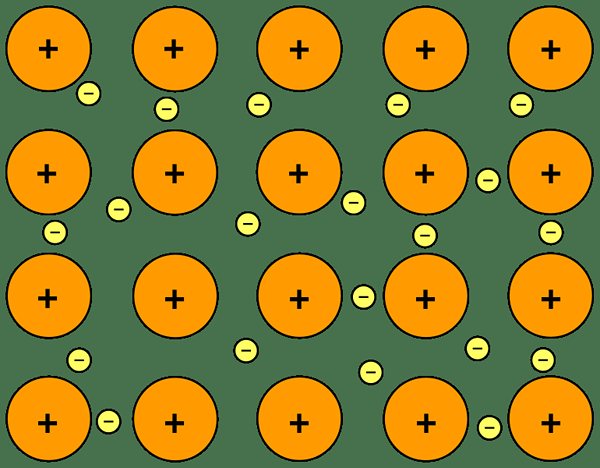
Rajah 01: ikatan ionik
Sebagai contoh, natrium klorida mempunyai ikatan ionik antara ion natrium dan klorida. Natrium adalah logam; Oleh itu, ia mempunyai elektronegativiti yang sangat rendah (0.9) berbanding dengan klorin (3.0). Kerana perbezaan elektronegativiti ini, klorin dapat menarik elektron dari natrium dan bentuk Cl- dan na+ ion. Oleh sebab itu, kedua -dua atom memperoleh konfigurasi elektronik gas yang stabil, mulia. Cl- dan na+ dipegang bersama oleh kuasa elektrostatik yang menarik, dengan itu membentuk ikatan ionik.
Apakah ikatan logam?
Logam adalah atom, yang boleh membentuk kation dengan mengeluarkan elektron. Kumpulan 1, kumpulan 2 dan elemen peralihan adalah logam. Kebanyakan logam masa berada dalam fasa pepejal. Jenis bentuk ikatan antara atom logam adalah "ikatan logam".
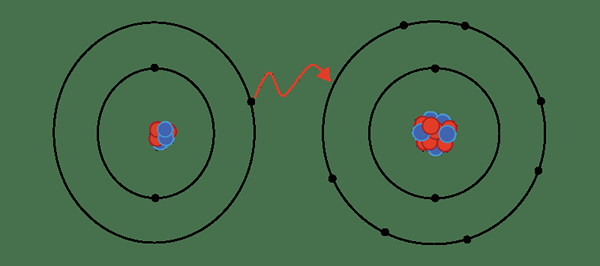
Logam melepaskan elektron di cengkerang luar mereka dan elektron ini bersurai antara kation logam. Oleh itu, kita menyebutnya sebagai "laut elektron yang diselaraskan". Interaksi elektrostatik antara elektron dan kation dipanggil ikatan logam.

Rajah 02: ikatan logam
Bilangan elektron yang dilepaskan oleh atom logam ke laut dan saiz kation menentukan kekuatan ikatan logam. Saiz kation berkadar songsang dengan kekuatan ikatan, dan juga bilangan elektron bahawa siaran atom logam berkadar secara langsung dengan kekuatan ikatan logam.
Selain itu, elektron boleh bergerak; Oleh itu, logam mempunyai keupayaan untuk menjalankan elektrik. Kerana logam ikatan logam mempunyai struktur yang diperintahkan. Titik lebur yang tinggi dan titik mendidih logam juga disebabkan oleh ikatan logam yang kuat ini. Logam kuat dan tidak rapuh, kerana alasan yang sama.
Apakah perbezaan antara ikatan ionik dan ikatan logam?
Ikatan ionik adalah sejenis ikatan kimia yang berlaku di antara dua ion yang bertentangan dengan ikatan logam adalah jenis ikatan kimia yang berlaku dalam kekisi logam. Oleh itu, perbezaan utama antara ikatan ionik dan ikatan logam adalah bahawa ikatan ionik berlaku antara ion positif dan negatif manakala ikatan logam berlaku antara ion positif dan elektron.
Sebagai satu lagi perbezaan penting antara ikatan ionik dan ikatan logam, kita dapat mempertimbangkan pengaruh elektronegativiti atom pada kekuatan ikatan. Itu dia; Elektronegativiti tidak mempunyai pengaruh terhadap ikatan logam kerana jenis atom yang sama terlibat dalam ikatan tetapi, kekuatan ikatan sangat dipengaruhi oleh perbezaan elektronegativiti antara ion positif dan negatif dalam ikatan ionik. Tambahan pula, ikatan ionik jauh lebih kuat daripada ikatan logam.
Infographic di bawah perbezaan antara ikatan ionik dan ikatan logam menunjukkan lebih banyak perbezaan antara kedua -dua bon.
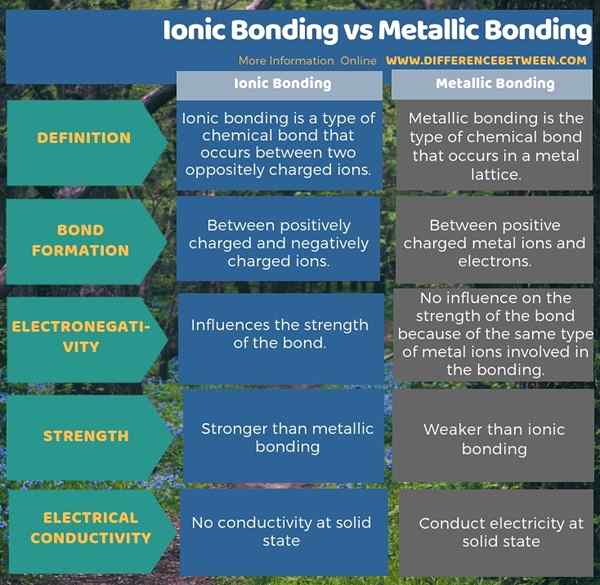
Ringkasan -ikatan ikatan ionik vs ikatan logam
Terdapat tiga jenis utama ikatan kimia. Mereka adalah ikatan ionik, ikatan kovalen dan ikatan logam. Perbezaan utama antara ikatan ionik dan ikatan logam adalah bahawa ikatan ionik berlaku antara ion positif dan negatif manakala ikatan logam berlaku antara ion positif dan elektron.
Rujukan:
1. Libretexts. "Ikatan Ionik dan kovalen."Kimia Libretexts, Yayasan Sains Kebangsaan, 28 Feb. 2018. Terdapat di sini
2. Libretexts. "Ikatan logam."Kimia Libretexts, Yayasan Sains Kebangsaan, 31 Julai 2018. Terdapat di sini
Ihsan gambar:
1."Ikatan Ionik" oleh Eliseetc - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia
2."Ikatan Metalik" oleh Muskid - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia


