Perbezaan antara pepejal ionik dan molekul
Perbezaan utama - ionik vs pepejal molekul
Bahan pepejal adalah sebatian yang wujud dalam keadaan pepejal pada suhu dan tekanan tertentu. Keadaan pepejal bermaksud, atom, molekul atau ion dalam bahan itu dikemas dengan ketat, mengelakkan pergerakan spesies kimia tersebut (tidak seperti cecair atau gas). Terdapat dua jenis bahan pepejal utama; pepejal ionik dan pepejal molekul. Sebatian ionik mengandungi ion yang dipegang bersama melalui ikatan kimia ionik. Bon Ionik adalah daya tarikan elektrostatik antara ion yang bertentangan. Pepejal molekul adalah bahan pepejal yang mengandungi molekul diskret yang dipegang bersama melalui kuasa van der waal. The Perbezaan utama antara pepejal ionik dan pepejal molekul adalah bahawa Pepejal ionik mengandungi ikatan kimia ionik manakala pepejal molekul mengandungi daya van der waal.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah pepejal ionik
3. Apakah pepejal molekul
4. Perbandingan sampingan - Ionic vs pepejal molekul dalam bentuk jadual
5. Ringkasan
Apakah pepejal ionik?
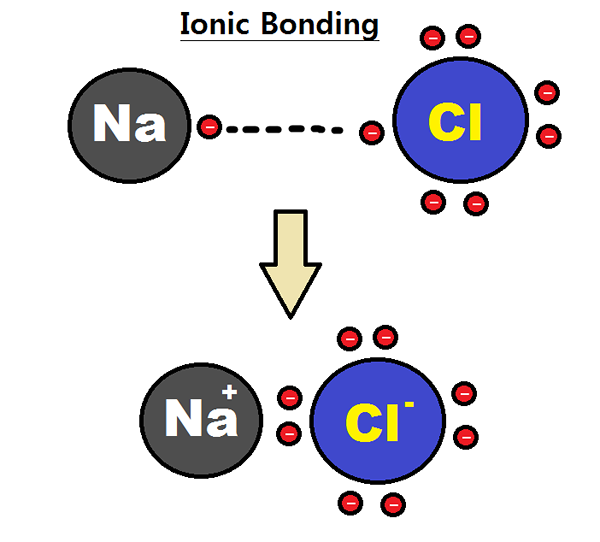
Pepejal ionik adalah sebatian pepejal yang terdiri daripada ion yang bertentangan dengan yang dipegang bersama oleh tarikan elektrostatik. Ion -ion adalah ion yang dikenakan positif yang merupakan kation dan ion yang dikenakan negatif yang dipanggil anion. Ikatan kimia antara ion ini dikenali sebagai ikatan ionik. Caj keseluruhan pepejal ionik adalah neutral. Itu kerana kation dikelilingi oleh anion dan sebaliknya.
Pepejal ionik boleh mengandungi ion mudah seperti NA+ dan Cl- atau ion kompleks seperti ion ammonium (NH4+). Pepejal ionik yang mengandungi h+ ion disebut sebagai sebatian berasid kerana pepejal ini melepaskan h+ ion apabila dibubarkan di dalam air (ia mengurangkan pH medium berair). Pepejal ionik yang mengandungi oh- ion disebut sebagai sebatian asas kerana mereka melepaskan OH- ion (ia meningkatkan pH).
Pepejal ionik biasanya mempunyai titik lebur yang tinggi dan titik mendidih. Pepejal ini sukar dan rapuh. Apabila pepejal ionik cair, ia menjadi sangat konduktif kerana bentuk cair sebatian ionik mengandungi ion yang dapat menjalankan elektrik. Pepejal ionik boleh dibentuk melalui proses yang berbeza seperti penyejatan, hujan, pembekuan, dan lain -lain.

Rajah 01: Pembentukan ikatan ionik
Biasanya, pepejal ionik mempunyai struktur kristal biasa. Di sana, ion -ion itu dikemas dengan ketat sedemikian rupa sehingga tenaga kekisi diminimumkan. Tenaga Kekisi adalah jumlah tenaga yang diperlukan untuk membentuk kekisi dari ion yang dipisahkan sepenuhnya.
Apakah pepejal molekul?
Pepejal molekul adalah sejenis pepejal di mana molekul dipegang bersama oleh daya van der Waals dan bukannya oleh ikatan ionik atau kovalen. Pepejal molekul mengandungi molekul diskret. Kekuatan van der Waal yang mengikat molekul ini antara satu sama lain lebih lemah daripada ikatan kovalen atau ionik. Molekul yang terdapat dalam pepejal molekul ini boleh monoatomik, diatomik atau bahkan polyatomik.
Oleh kerana daya intermolecular dalam pepejal molekul sangat lemah, sebatian pepejal ini mempunyai titik lebur yang lebih rendah (selalunya ia kurang daripada 300◦ C). dan juga pepejal molekul ini agak lembut dan mempunyai kepadatan yang lebih rendah. Walau bagaimanapun, terdapat ikatan hidrogen, interaksi dipole-dipole, pasukan London, dan lain-lain. juga (bukan pasukan van der waal).
Angkatan Van der Waal dapat diperhatikan antara molekul nonpolar. Interaksi dipole-dipole dapat dilihat dalam molekul kutub. Bon hidrogen hadir di antara molekul yang mengandungi kumpulan berfungsi seperti O-H, N-H dan F-H.
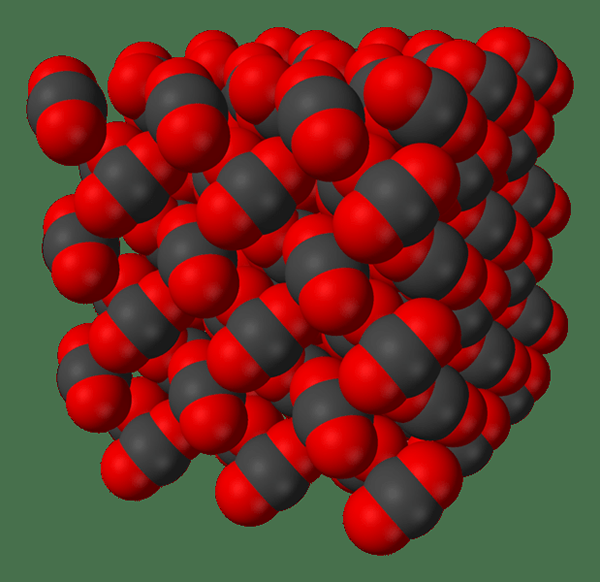
Rajah 02: Rajah yang menunjukkan molekul karbon dioksida dalam bentuk pepejal
Kekuatan van der Waal yang lemah di antara molekul dalam pepejal molekul menentukan sifat pepejal. Sebahagian daripada sifat ini termasuk titik lebur dan mendidih yang rendah, kekuatan mekanikal yang rendah, kekonduksian elektrik yang rendah, kekonduksian terma yang rendah, dan lain -lain.
Apakah perbezaan antara pepejal ionik dan molekul?
Ionic vs pepejal molekul | |
| Pepejal ionik adalah sebatian pepejal yang terdiri daripada ion yang bertentangan dengan yang dipegang bersama oleh tarikan elektrostatik. | Pepejal molekul adalah sejenis pepejal di mana molekul dipegang bersama oleh daya van der Waals dan bukannya oleh ikatan ionik atau kovalen. |
| Ikatan kimia | |
| Pepejal ionik mempunyai ikatan ionik. | Pepejal molekul mempunyai kuasa van der waal terutamanya, dan boleh ada ikatan hidrogen, interaksi dipole-dipole, pasukan London, dan lain-lain. juga. |
| Kekuatan ikatan | |
| Pepejal ionik mempunyai ikatan yang kuat. | Pepejal molekul mempunyai ikatan yang lemah. |
| Komponen | |
| Pepejal ionik mempunyai kation dan anion. | Pepejal molekul mempunyai molekul kutub atau nonpolar. |
| Titik lebur dan mendidih | |
| Pepejal ionik mempunyai titik lebur dan mendidih yang tinggi. | Pepejal molekul mempunyai titik lebur dan mendidih yang rendah. |
| Ketumpatan | |
| Ketumpatan pepejal ionik sangat tinggi. | Ketumpatan pepejal molekul sangat rendah. |
| Alam | |
| Pepejal ionik sukar dan rapuh. | Pepejal molekul agak lembut. |
Ringkasan -Ionic vs pepejal molekul
Pepejal ionik adalah sebatian pepejal yang diperbuat daripada kation dan anion. Terdapat daya tarikan elektrostatik antara ion yang bertentangan ini. Pepejal molekul mempunyai molekul yang mempunyai daya intermolecular di antara mereka. Mereka adalah interaksi kimia yang lemah. Perbezaan antara pepejal ionik dan pepejal molekul ialah pepejal ionik mengandungi ikatan kimia ionik manakala pepejal molekul mengandungi daya van der waal.
Rujukan:
1.Helmenstine, Anne Marie, D. "Pepejal molekul - definisi dan contoh."Thoughtco, Feb. 19, 2017. Terdapat di sini
2."Pepejal Ionik."Kimia Libretexts, Libretexts, 21 Julai 2016. Terdapat di sini
3."Pepejal molekul."Wikipedia, Yayasan Wikimedia, 27 Feb. 2018. Terdapat di sini
Ihsan gambar:
1.'Ionicbondingrh11'by rhannosh - kerja sendiri, (cc by -sa 3.0) melalui Commons Wikimedia
2.'Karbon-dioksida-kristal-3d-vdw'by Ben Mills-Kerja sendiri, (domain awam) melalui Commons Wikimedia


