Perbezaan antara ikatan ionik dan kovalen
The Perbezaan utama antara ikatan ionik dan kovalen ialah ikatan ionik berlaku di antara atom yang mempunyai elektronegativiti yang sangat berbeza manakala ikatan kovalen berlaku di antara atom dengan perbezaan elektronegativiti yang sama atau sangat rendah.
Seperti yang dicadangkan oleh ahli kimia Amerika g.N.Lewis mencadangkan bahawa atom stabil apabila mereka mengandungi lapan elektron dalam cangkang valensi mereka. Kebanyakan atom mempunyai kurang daripada lapan elektron dalam kerang valensi mereka (kecuali gas mulia dalam kumpulan 18 jadual berkala); Oleh itu, mereka tidak stabil. Atom -atom ini cenderung bertindak balas antara satu sama lain untuk menjadi stabil. Oleh itu, setiap atom dapat mencapai konfigurasi elektronik gas mulia. Ikatan ionik dan kovalen adalah dua jenis utama ikatan kimia, yang menghubungkan atom dalam sebatian kimia.

Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah ikatan ionik
3. Whare adalah ikatan kovalen
4. Perbandingan sampingan - ikatan kovalen ionik vs dalam bentuk jadual
5. Ringkasan
Apakah ikatan ionik?
Atom boleh mendapatkan atau kehilangan elektron dan membentuk zarah yang negatif atau positif; yang kita panggil ion. Terdapat interaksi elektrostatik antara ion. Ikatan ionik adalah daya yang menarik antara ion -ion yang bertentangan ini. Elektronegativiti atom dalam ikatan ionik sebahagian besarnya mempengaruhi kekuatan interaksi elektrostatik antara ion.

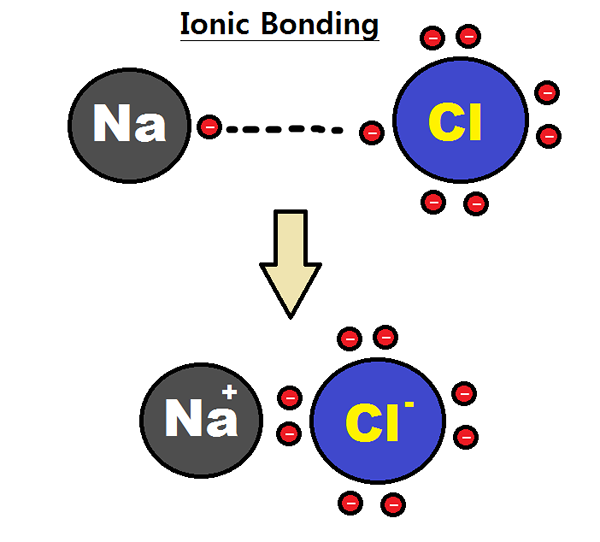
Rajah 01: Pembentukan ikatan ionik antara atom natrium dan klorin
Elektronegativiti adalah pengukuran pertalian atom untuk elektron. Atom, dengan elektronegativiti yang tinggi dapat menarik elektron dari atom dengan elektronegativiti yang rendah untuk membentuk ikatan ionik. Sebagai contoh, natrium klorida mempunyai ikatan ionik antara ion natrium dan klorida. Natrium adalah logam dan klorin adalah nonmetal; Oleh itu, ia mempunyai elektronegativiti yang sangat rendah (0.9) berbanding dengan klorin (3.0). Kerana perbezaan elektronegativiti ini, klorin dapat menarik elektron dari natrium dan bentuk Cl-. Pada masa yang sama, natrium membentuk na+ ion. Oleh sebab itu, kedua -dua atom mendapat konfigurasi elektronik gas mulia yang stabil. Cl- dan na+ dipegang bersama oleh kuasa elektrostatik yang menarik, sehingga membentuk ikatan ionik; Ikatan NA-CL.
Apakah ikatan kovalen?
Apabila dua atom, mempunyai perbezaan elektronegativiti yang sama atau sangat rendah, bertindak balas bersama, mereka membentuk ikatan kovalen dengan berkongsi elektron. Dengan cara ini, kedua -dua atom dapat memperoleh konfigurasi elektronik gas mulia dengan berkongsi elektron. Molekul adalah produk yang dihasilkan dari pembentukan ikatan kovalen antara atom. Contohnya, atom elemen yang sama bergabung untuk membentuk molekul seperti CL2, H2, atau p4, Setiap atom mengikat dengan yang lain melalui ikatan kovalen.
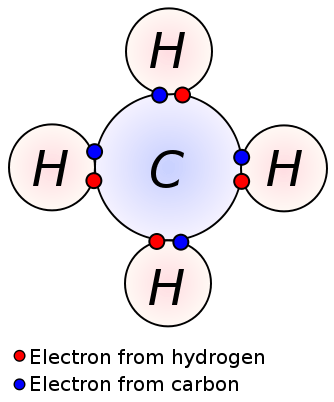
Rajah 02: Ikatan kovalen antara atom karbon dan hidrogen dalam molekul metana
Molekul metana (CH4) juga mempunyai ikatan kovalen antara atom karbon dan hidrogen; Terdapat empat ikatan kovalen antara satu atom karbon pusat dan empat atom hidrogen (empat ikatan C-H). Metana adalah contoh molekul yang mempunyai ikatan kovalen antara atom dengan perbezaan elektronegativiti yang sangat rendah.
Apakah perbezaan antara ikatan ionik dan kovalen?
Ikatan kovalen vs ionik | |
| Hubungan kimia antara dua atom yang disebabkan oleh daya elektrostatik antara ion-ion yang dilanggar dalam sebatian ionik. | Hubungan kimia antara dua atom atau ion di mana pasangan elektron dikongsi di antara mereka. |
| Bilangan atom | |
| Berlaku antara logam dan bukan logam. | Paling biasa berlaku di antara dua logam. |
| Bilangan elektron | |
| Pemindahan elektron lengkap berlaku. | Berlaku apabila dua (atau lebih) elemen berkongsi elektron. |
| Sebatian | |
| Biasanya dilihat sebagai kristal, di mana beberapa ion yang dikenakan positif mengelilingi ion yang dikenakan negatif. | Atom yang terikat oleh ikatan kovalen wujud sebagai molekul, yang pada suhu bilik, terutamanya wujud sebagai gas atau cecair. |
| Polariti | |
| Ikatan ionik mempunyai polariti yang tinggi. | Ikatan kovalen mempunyai polariti yang rendah. |
| Ciri-ciri fizikal | |
| Sebatian ionik mempunyai titik lebur yang sangat tinggi dan titik mendidih, berbanding dengan molekul kovalen. | Molekul kovalen mempunyai titik lebur yang rendah dan titik mendidih berbanding dengan sebatian ionik. |
| Kelarutan air | |
| Dalam pelarut kutub (seperti air), sebatian ionik membubarkan ion melepaskan; Penyelesaian sedemikian mampu menjalankan elektrik. | Dalam pelarut kutub, molekul kovalen tidak larut dengan ketara; Oleh itu, penyelesaian ini tidak mampu menjalankan elektrik. |
Ringkasan -Ionic Vs Covalent Bonds
Ikatan ionik dan kovalen adalah dua jenis utama ikatan kimia yang wujud dalam sebatian. Perbezaan antara ikatan ionik dan kovalen adalah bahawa ikatan ionik berlaku di antara atom yang mempunyai elektronegativiti yang sangat berbeza manakala ikatan kovalen berlaku di antara atom dengan perbezaan elektronegativiti yang sama atau sangat rendah.
Rujukan:
1. Helmenstine, Anne Marie, PH.D. "Definisi bon ionik."Thoughtco, Feb. 10, 2017. Terdapat di sini
2. Helmenstine, Anne Marie, PH.D. "Definisi bon kovalen."Thoughtco, Feb. 7, 2018. Terdapat di sini
Ihsan gambar:
1.'Ionicbondingrh11'by rhannosh - kerja sendiri, (cc by -sa 3.0) melalui Commons Wikimedia
2.'Covalent'By Dynablast - Dibuat dengan Inkscape, (CC BY -SA 2.5) Melalui Wikimedia Commons


