Perbezaan antara iodometri dan iodimetri

The Perbezaan utama Antara iodometri dan iodimetri ialah Kita boleh menggunakan iodometri untuk mengukur ejen pengoksidaan, sedangkan kita boleh menggunakan iodimetri untuk mengukur ejen pengurangan.
Iodometri dan iodimetri adalah dua kaedah titrasi biasa yang berguna dalam kimia analisis. Asas kedua-dua jenis titrasi ini adalah pengurangan pengoksidaan, dan kita boleh menggunakannya untuk menentukan spesies redoks secara kuantitatif. Asas titrasi adalah tindak balas antara analit dan reagen standard yang dikenali sebagai titran. Kita dapat menentukan kuantiti analit jika kita tahu reaksi, stoikiometri dan jumlah/jisim titran yang diperlukan untuk bertindak balas sepenuhnya dengan analit. Selain itu, kita boleh menggunakan iodin untuk titrasi redoks ini kerana keupayaannya bertindak balas dengan cepat dengan banyak spesies. Kebolehulangan iodin/iodida, tindak balas juga merupakan kelebihan apabila menggunakannya dalam tindak balas iodometrik.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu iodometri
3. Apa itu iodimetri
4. Perbandingan sampingan - iodometri vs iodimetri dalam bentuk jadual
5. Ringkasan
Apa itu iodometri?
Dalam iodometri, iodida bertindak balas dengan ejen pengoksidaan yang lain dalam medium medium atau neutral berasid. Apabila tindak balas ini berlaku, iodida (kami menambah iodida dalam bentuk ki) mengoksidakan ke yodium dan spesies lain akan menjalani pengurangan oleh iodida. Kemudian kita dapat menonjolkan yodium yang dikeluarkan dengan spesies lain. Spesies titrating ini merupakan penyelesaian standard ejen pengurangan, yang mampu mengurangkan iodin kembali ke bentuk iodida. Biasanya, kami menggunakan penyelesaian thiosulfat standard untuk ini. Sebagai contoh, jika kita mahu mengukur jumlah klorin yang dibubarkan dalam campuran, berikut adalah kaedah untuk menjalankan titrasi iodometrik.
Pertama, kita harus mengambil jumlah jumlah yang diketahui dari campuran (di mana klorin dibubarkan) menjadi kelalang titrasi. Kemudian kita dapat menonjolkannya dengan penyelesaian ki yang diketahui, dan kita dapat mencari kelantangan yang dimakan.
Berikutan tindak balas redoks akan berlaku dalam kelalang reaksi;
Cl2 + 2i- -> 2 Cl- + I2

Rajah 01: Perubahan warna dalam iodometri
Kemudian kita harus menjalankan titrasi lain dengan campuran yang sama untuk menentukan jumlah yodium yang dikeluarkan. Untuk ini, kita boleh titrate campuran dengan penyelesaian thiosulfat standard. Kita perlu menambah kanji sebagai penunjuk, untuk menentukan titik akhir reaksi ini. Dengan iodin dan kanji dalam campuran, ia akan muncul dalam warna gelap, tetapi pada titik akhir apabila semua yodium selesai, warna gelap akan hilang.
I2 + 2 s2O32- → s4O62- + 2 i-
Dari dua titrasi di atas, kita dapat menentukan jumlah Cl2.
Apa itu iodimetri?
Dalam iodimetri, ia menggunakan iodin percuma untuk menjalani titrasi dengan ejen pengurangan. Oleh itu, yodium mengurangkan kepada iodida, dan iodin akan mengoksidakan spesies lain.

Rajah 02: Melaksanakan titrasi
Oleh kerana kita tidak dapat dengan mudah menyediakan penyelesaian iodin percuma, kita perlu mencampurkan yodium dengan kalium iodida dan ki3 penyelesaian untuk menyediakan penyelesaian yang diperlukan. Dan penyelesaian standard ini digunakan untuk titrasi iodometrik.
Ki+i2 → ki3
Tindak balas berikut berlaku semasa titrating. Kita boleh menggunakan kanji sebagai penunjuk untuk titrasi iodometrik juga.
I2 + Mengurangkan ejen → 2 i-
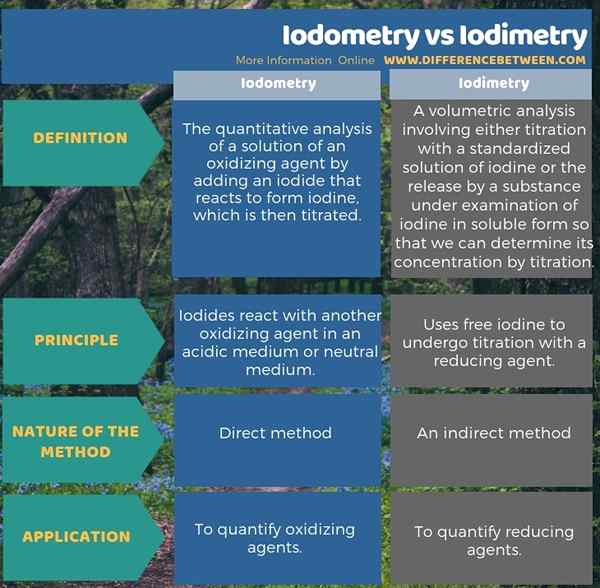
Apakah perbezaan antara iodometri dan iodimetri?
Iodometri adalah analisis kuantitatif penyelesaian ejen pengoksidaan dengan menambahkan iodida yang bertindak balas untuk membentuk iodin, yang kemudian dititrasi manakala iodimetri adalah analisis volumetrik yang melibatkan sama ada titrasi dengan penyelesaian standard iodin, atau pelepasan oleh bahan di bawah peperiksaan iodin dalam bentuk larut, supaya kita dapat menentukan kepekatannya dengan titrasi. Ini adalah satu perbezaan antara iodometri dan iodimetri.
Tambahan pula, perbezaan lain antara iodometri dan iodimetri ialah, dalam iodometri, iodida bertindak balas dengan agen pengoksidaan lain dalam medium medium atau neutral yang berasid semasa dalam iodimetri, ia menggunakan yodium percuma untuk menjalani titrasi dengan ejen pengurangan.
Infographic di bawah membentangkan perbezaan antara iodometri dan iodimetri dalam bentuk jadual.
Ringkasan -iodometri vs iodimetri
Walaupun kedua -dua istilah iodometri dan bunyi iodimetri serupa, mereka adalah dua teknik yang berbeza yang kami gunakan dalam kimia analisis. Perbezaan utama antara iodometri dan iodimetri ialah kita boleh menggunakan iodometri untuk mengukur ejen pengoksidaan, sedangkan kita boleh menggunakan iodimetri untuk mengukur ejen pengurangan.
Rujukan:
1. "Iodometri."Wikipedia, Yayasan Wikimedia, 9 Sept. 2018. Terdapat di sini
2. Naviglio, Daniele. "Iodometri dan iodimetri, Daniele Naviglio" Kimia Analisis "Agraria" Federica E-Learning."Federica, Pembelajaran Web Federica, Università Di Napoli Federico II, 20 Mac. 2012. Terdapat di sini
Ihsan gambar:
1."Campuran Titrasi Iodometrik" oleh LHCHEM - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia
2."Demonstrasi Titrasi Tahap Sekolah" oleh UCL - Flickr, (CC oleh 2.0) melalui Commons Wikimedia


