Perbezaan antara reaksi redoks redoks dan tidak seimbang intramolekul
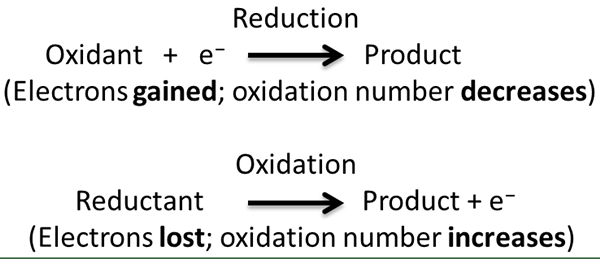
The Perbezaan utama antara reaksi redoks redoks dan tidak seimbang adalah bahawa Reaksi redoks intramolekul berlaku apabila molekul tunggal mengalami pengoksidaan dan pengurangan unsur kimia yang sama atau unsur kimia yang berlainan manakala tindak balas redoks yang tidak seimbang melibatkan pengoksidaan dan pengurangan unsur kimia yang sama dalam substrat tunggal.
Reaksi redoks intramolekul dan tindak balas redoks yang tidak seimbang adalah dua jenis tindak balas kimia bukan organik di mana tindak balas pengoksidaan dan pengurangan berlaku selari antara satu sama lain. Kedua-dua tindak balas kimia ini melibatkan pengoksidaan dan pengurangan separuh reaksi yang berlaku dalam sebatian kimia yang sama/ dalam molekul substrat tunggal. Kedua-dua jenis berbeza antara satu sama lain mengikut elemen kimia di mana reaksi separuh ini berlaku.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah reaksi redoks intramolekul
3. Apakah tindak balas redoks yang tidak seimbang
4. Perbandingan sampingan - redoks intramolekul vs reaksi redoks yang tidak seimbang dalam bentuk tabular
5. Ringkasan
Apakah reaksi redoks intramolekul?
Reaksi redoks intramolekul adalah tindak balas kimia yang melibatkan substrat tunggal di mana pengoksidaan dan pengurangan berlaku dalam elemen kimia yang sama atau dalam dua elemen kimia yang berbeza. Dalam erti kata lain, dalam beberapa tindak balas redoks intramolekul, pengoksidaan dan pengurangan berlaku dalam elemen kimia yang sama manakala dalam reaksi redoks intramolecular lain, pengoksidaan dan pengurangan berlaku dalam dua elemen kimia yang berbeza yang berada dalam molekul yang sama. Sekiranya pengoksidaan dan pengurangan berlaku dalam elemen kimia yang sama, maka kita namakannya sebagai tidak seimbang.

Rajah 01: Proses kimia reaksi redoks
Apakah tindak balas redoks yang tidak seimbang?
Reaksi redoks yang tidak seimbang adalah tindak balas kimia di mana pengoksidaan dan pengurangan berlaku dalam elemen kimia yang sama dari satu molekul substrat. Dalam tindak balas jenis ini, molekul substrat tunggal berfungsi dengan baik, mengoksida dan mengurangkan reaksi separuh. Di sini, sebahagian daripada molekul menjalani pengoksidaan manakala bahagian lain dari molekul mengalami pengurangan; Walau bagaimanapun, kedua -dua bahagian molekul ini melibatkan elemen kimia yang sama di mana pengoksidaan atau pengurangan berlaku. Contohnya adalah seperti berikut:
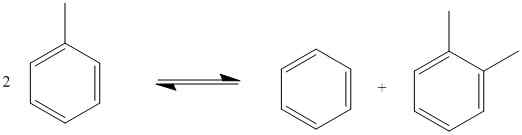
Rajah 02: Contoh reaksi redoks yang tidak seimbang
Satu lagi contoh biasa jenis tindak balas kimia ini ialah ketidakselarasan atom oksigen dalam hidrogen peroksida, molekul H2O2. Di sini, oksigen dalam molekul hidrogen peroksida mengalami pengoksidaan untuk membentuk gas oksigen, dan molekul yang sama mengalami pengurangan untuk membentuk molekul air.
Apakah perbezaan antara reaksi redoks redoks intramolekul dan tidak seimbang?
Reaksi redoks adalah tindak balas kimia di mana pengoksidaan separuh reaksi dan reaksi pengurangan berlaku selari antara satu sama lain. Perbezaan utama antara reaksi redoks redoks intramolekul dan tidak seimbang ialah tindak balas redoks intramolekul berlaku apabila molekul dua bahan yang berbeza bertindak balas antara satu sama lain manakala tindak balas redoks yang tidak seimbang melibatkan pengoksidaan dan pengurangan molekul tunggal.
Ketidakselarasan c6H2(Tidak2)3Ch3 untuk membentuk n2 melalui pengurangan dan c melalui pengoksidaan adalah contoh tindak balas redoks intramolekul manakala ketidakselarasan atom oksigen dalam molekul hidrogen peroksida adalah contoh tindak balas redoks yang tidak seimbang.
Infographic di bawah meringkaskan perbezaan antara reaksi redoks redoks intramolekul dan tidak seimbang dalam bentuk tabular untuk perbandingan bersebelahan.

Ringkasan -Redoks intramolekul vs reaksi redoks yang tidak seimbang
Reaksi redoks adalah tindak balas kimia yang melibatkan pengoksidaan dan tindak balas pengurangan yang berlaku selari antara satu sama lain. Perbezaan utama antara reaksi redoks redoks intramolekul dan tidak seimbang ialah tindak balas redoks intramolekul berlaku apabila molekul dua bahan yang berbeza bertindak balas antara satu sama lain manakala tindak balas redoks yang tidak seimbang melibatkan pengoksidaan dan pengurangan molekul tunggal.
Rujukan:
1. Mott, Vallerie. "Jenis tindak balas redoks." Lumen - Pengenalan kepada Kimia, Terdapat di sini.
2. Helmenstine, Anne Marie. "Takrif ketidakseimbangan dalam kimia." Pemikiran, Terdapat di sini.


