Perbezaan antara asid bromida hidrogen dan hidrobromik
The Perbezaan utama Antara hidrogen bromida dan asid hidrobromik ialah Hidrogen bromida adalah molekul yang mempunyai atom hidrogen yang terikat kepada atom bromin melalui ikatan kimia kovalen manakala asid hidrobromik adalah asid kuat yang terbentuk daripada pembubaran bromida hidrogen di dalam air.
Hydrogen Bromide adalah sebatian bukan organik yang mudah. Ia mengandungi atom hidrogen yang mempunyai ikatan kovalen tunggal dengan atom bromin. Apabila bahan ini dibubarkan di dalam air, ia membentuk asid hidrobromik.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu bromida hidrogen
3. Apakah asid hidrobromik
4. Perbandingan sampingan - hidrogen bromida vs asid hidrobromik dalam bentuk tabular
5. Ringkasan
Apa itu bromida hidrogen?
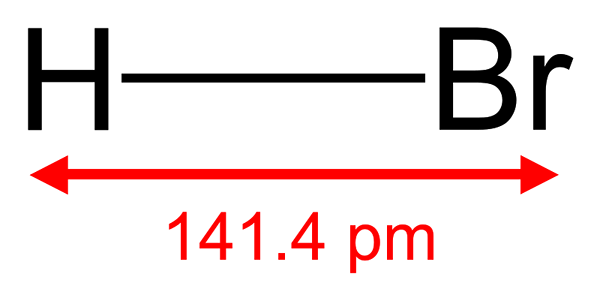
Hidrogen bromida adalah sebatian bukan organik yang mempunyai formula kimia HBr. Ia adalah sebatian molekul diatomik, dan kita boleh mengkategorikannya sebagai halida hidrogen. Dalam bentuk murni, hidrogen bromida adalah gas tanpa warna dan mempunyai bau yang acrid. Selain itu, HBR larut dalam air, alkohol, dan beberapa pelarut organik lain.

Rajah 01: Struktur molekul bromida hidrogen
Bahan ini sangat larut dalam air. Ia boleh membentuk asid hidrobromik apabila dibubarkan di dalam air dan tepu hingga kira -kira 68.85%. Kedua -dua bentuk anhydrous dan bentuk akueus bromida hidrogen adalah reagen penting dalam penyediaan sebatian bromida.
Hidrogen bromida penting dalam menghasilkan sebatian bromin bukan organik dan organik. Selain itu, penambahan radikal bebas HBR ke alkenes memberikan bromida alkil. Ejen alkilat ini adalah prekursor penting untuk derivatif amina berlemak.
Kita boleh menyediakan hidrogen bromida secara industri melalui menggabungkan hidrogen dan bromin pada suhu antara 200 dan 400 suhu darjah Celsius. Biasanya, tindak balas ini dipangkin oleh platinum atau asbestos. Selain itu, sintesis makmal bromida hidrogen dilakukan terutamanya oleh penyulingan larutan natrium bromida atau kalium bromida dengan asid fosforik atau asid sulfurik.
Apabila mempertimbangkan keselamatan mengenai bromida hidrogen, ia sangat menghakis dan menjengkelkan untuk penyedutan; Oleh itu, kita harus mengendalikan bahan ini dengan teliti.
Apakah asid hidrobromik?
Asid hidrobromik adalah asid kuat yang disediakan dengan membubarkan bromida hidrogen di dalam air. Ia adalah asid yang lebih kuat daripada asid hidroklorik tetapi kurang berasid daripada asid hidroiodik. Walau bagaimanapun, ini adalah salah satu asid mineral yang paling kuat. Asid ini muncul sebagai cecair kuning yang tidak berwarna/lemah, dan ia mempunyai bau yang acrid.

Rajah 02: Penampilan asid hidrobromik
Asid hidrobromik mempunyai banyak kegunaan, termasuk penggunaan asid ini dalam pengeluaran bromida bukan organik, terutama bromida zink, kalsium, dan natrium. Selain itu, ia adalah reagen yang berguna dalam menjana sebatian organobromin. Asid hidrobromik dapat memangkin tindak balas alkilasi dan pengekstrakan bijih tertentu.
Apabila mempertimbangkan sintesis asid hidrobromik, ia boleh disediakan di makmal melalui tindak balas antara BR2, SO2, dan air. Reaksi ini memberikan asid hidrobromik dan asid sulfurik sebagai hasil sampingan. Walau bagaimanapun, kaedah pengeluaran makmal biasa ialah pengeluaran HBR anhydrous, yang kemudian dibubarkan di dalam air.
Apakah perbezaan antara asid bromida hidrogen dan hidrobromik?
Asid hidrobromik adalah bentuk bahan bromida hidrogen berair. Perbezaan utama antara hidrogen bromida dan asid hidrobromik ialah hidrogen bromida adalah molekul yang mempunyai atom hidrogen yang terikat kepada atom bromin melalui ikatan kimia kovalen manakala asid hidrobromik adalah asid kuat yang terbentuk dari pembubaran bromida hidrogen dalam air dalam air.
Di bawah jadual infographic lebih banyak perbezaan antara hidrogen bromida dan asid hidrobromik.

Ringkasan -Hydrogen Bromide vs Hydrobromic Acid
Asid hidrobromik adalah bentuk bahan bromida hidrogen berair. Perbezaan utama antara hidrogen bromida dan asid hidrobromik ialah hidrogen bromida adalah molekul yang mempunyai atom hidrogen yang terikat kepada atom bromin melalui ikatan kimia kovalen manakala asid hidrobromik adalah asid kuat yang terbentuk dari pembubaran bromida hidrogen dalam air dalam air.
Rujukan:
1. "Hidrogen bromida". Sains Langsung, boleh didapati di sini.
Ihsan gambar:
1. "Hidrogen-Bromide-2D-dimensi" oleh KES47-(domain awam) melalui Commons Wikimedia
2. "Asid Hydrobromic" oleh MDAXO - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


