Perbezaan antara ikatan hidrogen dan ikatan ionik
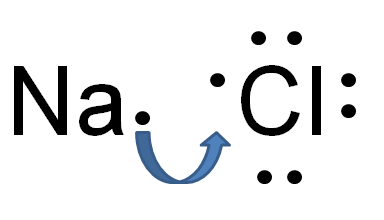
The Perbezaan utama antara ikatan hidrogen dan ikatan ionik adalah ikatan ionik wujud antara anion dan kation kekal, sedangkan ikatan hidrogen wujud antara caj negatif positif dan separa separa.
Ikatan kimia memegang atom dan molekul bersama. Bon penting dalam menentukan tingkah laku kimia dan fizikal molekul dan atom. Seperti yang dicadangkan oleh ahli kimia Amerika g.N.Lewis, atom stabil apabila mereka mengandungi lapan elektron dalam cangkang valensi mereka. Kebanyakan atom mempunyai kurang daripada lapan elektron dalam kerang valensi mereka (kecuali gas mulia dalam kumpulan 18 jadual berkala); Oleh itu, mereka tidak stabil. Atom -atom ini cenderung bertindak balas antara satu sama lain untuk menjadi stabil. Oleh itu, setiap atom dapat mencapai konfigurasi elektronik gas mulia. Ikatan ionik adalah satu ikatan kimia sedemikian, yang menghubungkan atom dalam sebatian kimia. Ikatan hidrogen adalah tarikan intermolecular antara molekul.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah ikatan hidrogen
3. Apakah ikatan ionik
4. Perbandingan sampingan - ikatan ikatan hidrogen vs ionik dalam bentuk jadual
5. Ringkasan
Apakah ikatan hidrogen?
Apabila hidrogen dilampirkan pada atom elektronegatif seperti fluorin, oksigen atau nitrogen, ia akan menghasilkan ikatan kutub. Oleh kerana elektronegativiti, elektron dalam ikatan tertarik kepada atom elektronegatif lebih daripada atom hidrogen. Oleh itu, atom hidrogen akan mendapat caj positif separa, sedangkan lebih banyak atom elektronegatif akan mendapat caj negatif separa. Apabila dua molekul yang mempunyai pemisahan caj ini dekat, daya tarikan meningkat antara hidrogen dan atom yang dikenakan negatif. Kami memanggil ikatan hidrogen ini.
Ikatan hidrogen agak kuat daripada interaksi dipole lain, dan mereka menentukan tingkah laku molekul. Contohnya, molekul air mempunyai ikatan hidrogen intermolecular. Satu molekul air boleh membentuk empat ikatan hidrogen dengan molekul air lain. Oleh kerana oksigen mempunyai dua pasangan tunggal, ia boleh membentuk dua ikatan hidrogen dengan hidrogen yang dikenakan positif. Kemudian, kita boleh memanggil kedua -dua molekul air sebagai dimer. Setiap molekul air dapat mengikat dengan empat molekul lain kerana keupayaan ikatan hidrogen. Ia menghasilkan titik mendidih yang lebih tinggi untuk air, walaupun molekul air mempunyai berat molekul yang rendah. Oleh itu, tenaga yang diperlukan untuk memecahkan ikatan hidrogen apabila mereka pergi ke fasa gas adalah tinggi.
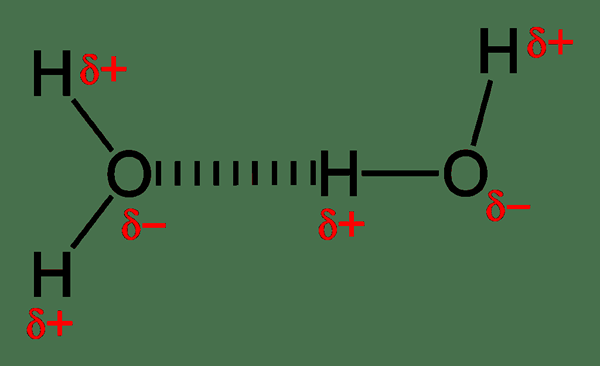
Rajah 01: Ikatan hidrogen antara molekul air
Tambahan pula, ikatan hidrogen menentukan struktur kristal ais. Susunan unik kisi ais membantu ia terapung di atas air; Oleh itu, melindungi kehidupan akuatik pada musim sejuk. Selain daripada ini, ikatan hidrogen memainkan peranan penting dalam sistem biologi. Struktur protein dan DNA tiga dimensi hanya berdasarkan ikatan hidrogen. Selain itu, ikatan hidrogen boleh dimusnahkan oleh pemanasan dan daya mekanikal.
Apakah ikatan ionik?
Atom dapat memperoleh atau kehilangan elektron dan membentuk zarah yang negatif atau positif. Zarah -zarah ini dipanggil ion. Terdapat interaksi elektrostatik antara ion. Ikatan ionik adalah daya yang menarik antara ion -ion yang bertentangan ini. Kekuatan interaksi elektrostatik sebahagian besarnya dipengaruhi oleh nilai elektronegativiti atom dalam ikatan ionik. Elektronegativiti memberikan pengukuran pertalian atom untuk elektron. Atom dengan elektronegativiti yang tinggi dapat menarik elektron dari atom dengan elektronegativiti yang rendah untuk membentuk ikatan ionik.
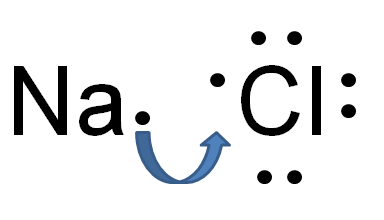
Rajah 02: Pembentukan ikatan ionik dalam natrium klorida
Sebagai contoh, natrium klorida mempunyai ikatan ionik antara ion natrium dan klorida. Natrium adalah logam; Oleh itu, ia mempunyai elektronegativiti yang sangat rendah (0.9) berbanding dengan klorin (3.0). Kerana perbezaan elektronegativiti ini, klorin dapat menarik elektron dari natrium dan bentuk cl- dan na+ ion. Oleh sebab itu, kedua -dua atom memperoleh konfigurasi elektronik gas yang stabil, mulia. Cl- dan Na+ dipegang bersama oleh daya elektrostatik yang sangat kuat, dengan itu membentuk ikatan ionik.
Apakah perbezaan antara ikatan hidrogen dan ikatan ionik?
Ikatan hidrogen adalah tarikan intermolecular manakala ikatan ionik adalah daya elektrostatik yang menarik. Perbezaan utama antara ikatan hidrogen dan ikatan ionik ialah ikatan ionik wujud antara anion dan kation kekal, sedangkan ikatan hidrogen wujud antara caj negatif positif dan separa separa. Di samping itu, ikatan ionik lebih kuat daripada ikatan hidrogen.
Selain itu, ikatan hidrogen berlaku apabila terdapat atom hidrogen dan atom elektronegatif manakala ikatan ionik berlaku di antara sebarang atom logam dan bukan logam. Jadi, ini adalah perbezaan yang signifikan antara ikatan hidrogen dan ikatan ionik. Di samping.
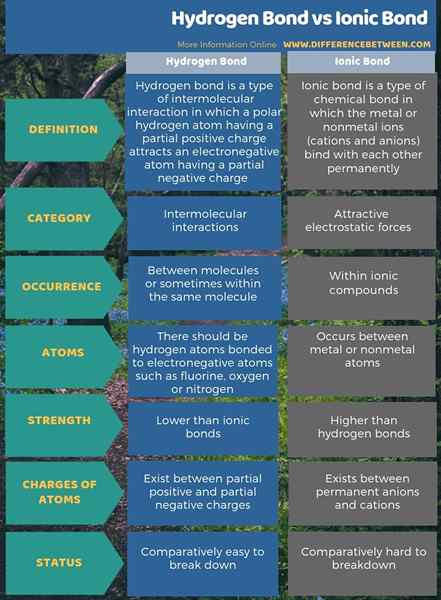
Ringkasan -ikatan hidrogen dan ikatan ionik
Ikatan ionik berlaku dalam sebatian ionik. Ikatan hidrogen adalah ikatan antara molekul. Perbezaan utama antara ikatan hidrogen dan ikatan ionik ialah ikatan ionik wujud antara anion dan kation kekal, sedangkan ikatan hidrogen wujud antara caj negatif positif dan separa separa.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi dan contoh ikatan hidrogen."Thoughtco, Mei. 6, 2019, boleh didapati di sini.
2. Helmenstine, Anne Marie. "Definisi bon ionik."Thoughtco, Jan. 26, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Hydrogen-Bonding-In-Water-2D" (Domain Awam) melalui Commons Wikimedia
2. "NaCl Ionic Bond" oleh Mhowison - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


