Perbezaan antara garam terhidrat dan garam anhydrous

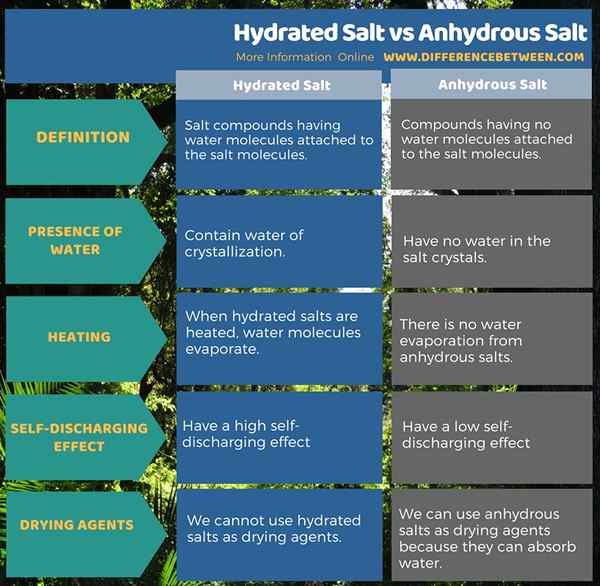
The Perbezaan utama antara garam terhidrat dan garam anhidrat adalah bahawa Molekul garam terhidrat dilampirkan pada molekul air manakala molekul garam anhydrous tidak dilampirkan pada sebarang molekul air. Sekiranya kita memanaskan garam terhidrasi, mereka memancarkan molekul air sebagai wap air.
Garam adalah sebatian yang mengandungi anion dan kation dalam bentuk kristal. Bentuk garam dari gabungan anion asid dan kation asas. Terdapat dua bentuk garam sebagai garam terhidrat dan garam anhydrous. Sebatian ini berbeza antara satu sama lain mengikut kehadiran atau ketiadaan molekul air. Kami memanggil molekul air ini "air penghabluran".
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu garam terhidrasi
3. Apa itu garam anhydrous
4. Perbandingan sampingan - garam terhidrat vs garam anhydrous dalam bentuk jadual
5. Ringkasan
Apa itu garam terhidrasi?
Garam terhidrasi adalah sebatian garam yang mempunyai molekul air yang dilekatkan pada molekul garam. Sebatian garam tertentu mengandungi sejumlah molekul air. Kami memanggil molekul ini "air penghabluran" kerana sebatian garam ini mempunyai molekul air yang dimasukkan ke dalam struktur penghabluran garam. Molekul air ini mengikat kimia dengan molekul garam. Molekul air ini menyebabkan bentuk kristal.

Rajah 01: sulfat tembaga terhidrat
Garam terhidrat ini terbentuk apabila pepejal ionik mengkristal dari larutan berair. Apabila kita mengeluarkan air ini dari kristal garam, ia menjadi anhidrat. Contoh umum garam hidrat adalah pentahydrate sulfat tembaga (CUSO4.5h2O). Oleh itu, jika kita memanaskan sebatian ini, ia berubah menjadi sulfat tembaga anhydrous. Itu kerana apabila dipanaskan, molekul air menguap.
Apa itu garam anhydrous?
Garam anhydrous adalah sebatian yang tidak mempunyai molekul air yang dilekatkan pada molekul garam. Kami menggunakan istilah ini kebanyakannya apabila air penghabluran dikeluarkan dari garam terhidrat. Oleh itu, istilah anhydrous merujuk kepada garam kering.

Rajah 02: Sulfat tembaga anhydrous bertukar menjadi warna biru apabila terhidrasi
Contohnya, natrium sulfat anhydrous bebas dari air. Oleh itu, kita boleh menggunakannya sebagai bahan pengeringan kerana ia dapat menyerap air dan ditukar menjadi bentuk terhidrat.
Apakah perbezaan antara garam terhidrasi dan garam anhydrous?
Garam terhidrasi adalah sebatian garam yang mempunyai molekul air yang dilekatkan pada molekul garam. Sebatian ini mengandungi air penghabluran. Jika kita memanaskan sebatian ini, mereka memancarkan molekul air sebagai wap air. Garam anhydrous adalah sebatian yang tidak mempunyai molekul air yang dilekatkan pada molekul garam. Sebatian ini tidak mempunyai molekul air dalam kristal garam.
Ringkasan -Garam terhidrat vs garam anhydrous
Garam adalah derivatif gabungan asid dan pangkalan. Terdapat dua bentuk garam sebagai garam terhidrat dan garam anhydrous. Perbezaan antara garam terhidrat dan garam anhydrous ialah molekul garam terhidrat dilampirkan pada molekul air manakala molekul garam anhydrous tidak dilekatkan pada sebarang molekul air.
Rujukan:
1. "Garam terhidrat."Pengangkutan mineral di tumbuh -tumbuhan. Terdapat di sini
2. Helmenstine, Anne Marie, PH.D. "Definisi anhydrous."Pemikiran, Jun. 13, 2018. Terdapat di sini
Ihsan gambar:
1.'Síran měnatý'by ondřej mangl - kerja sendiri, (domain awam) melalui commons wikimedia
2.'Hydrating-Copper (II) -Sulfate'by Benjah-Bmm27-Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia


