Perbezaan antara caj rasmi dan keadaan pengoksidaan
The Perbezaan utama antara caj rasmi dan keadaan pengoksidaan ialah Caj formal adalah caj atom dalam molekul yang kita kirakan dengan mengandaikan bahawa elektron dalam ikatan kimia dikongsi sama rata antara atom manakala keadaan pengoksidaan adalah bilangan elektron yang kehilangan atau keuntungan atau saham dengan atom lain.
Caj formal dan keadaan pengoksidaan adalah istilah yang berbeza walaupun kita biasanya menganggapnya sama. Caj rasmi menentukan bilangan elektron yang berlaku di sekitar atom molekul manakala keadaan pengoksidaan menentukan bilangan elektron yang ditukar antara atom semasa pembentukan molekul.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu caj rasmi
3. Apakah keadaan pengoksidaan
4. Perbandingan sampingan - caj formal vs keadaan pengoksidaan dalam bentuk jadual
5. Ringkasan
Apa itu caj rasmi?
Caj rasmi adalah caj atom dalam molekul yang kita kirakan dengan mengandaikan bahawa elektron dalam ikatan kimia dikongsi sama rata antara atom. Oleh itu, apabila menentukan caj rasmi, kita membandingkan bilangan elektron di sekitar atom neutral dan bilangan elektron di sekeliling atom tersebut apabila ia berada dalam molekul. Dalam penentuan caj rasmi ini, kita perlu menetapkan elektron molekul kepada atom individu. Di sini, kita perlu mempertimbangkan keperluan berikut juga;
- Kita perlu menetapkan elektron tanpa atom ke atom di mana elektron bukan ikatan berlaku
- Kita perlu membahagikan elektron ikatan sama antara atom yang dikongsi
Hubungan matematik untuk pengiraan ini adalah seperti berikut:
Caj rasmi = (bilangan elektron valensi dalam atom neutral) - (bilangan elektron pasangan tunggal) - (1/2*elektron pasangan bon)
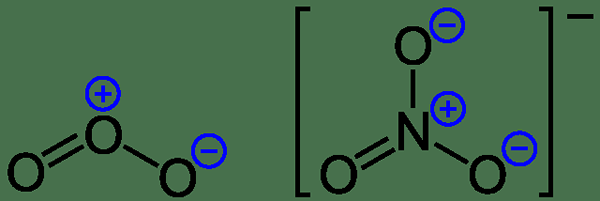
Rajah 1: Caj rasmi pada ozon dan anion nitrat
Marilah kita mempertimbangkan contoh untuk memahami fenomena ini. Untuk molekul ammonia, terdapat tiga ikatan N-H dan pasangan elektron tunggal pada atom nitrogen. Kemudian apabila boleh mengira berikut;
Caj rasmi n = 5 - 2 - 1/2*6 = 0
Caj rasmi H = 1 - 0 - 1/2*2 = 0
Apakah keadaan pengoksidaan?
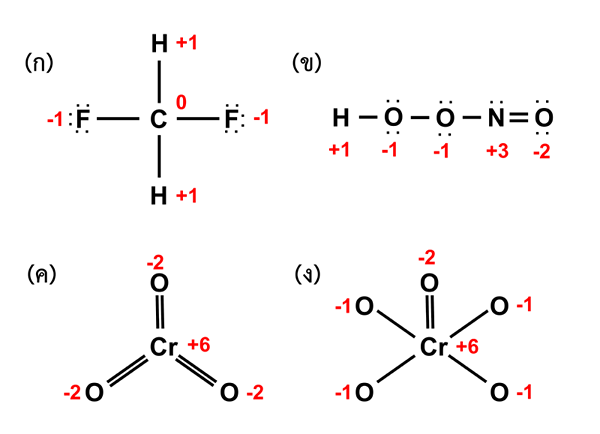
Keadaan pengoksidaan adalah bilangan elektron Atom tertentu boleh kehilangan, memperoleh atau berkongsi dengan atom lain. Istilah ini digunakan untuk sebarang elemen kimia dalam molekul (nombor pengoksidaan istilah digunakan terutamanya untuk atom logam pusat kompleks koordinasi walaupun kita menggunakan istilah ini secara bergantian). Keadaan pengoksidaan sebenarnya memberikan tahap pengoksidaan atom dalam sebatian. Kita harus selalu memberikan keadaan pengoksidaan sebagai jumlah keseluruhan, dan ia diwakili dalam nombor Hindu-Arab, termasuk pertuduhan atom. Sebagai contoh, keadaan pengoksidaan besi dalam FeO ialah +2.

Rajah 02: Pengoksidaan keadaan atom dalam molekul yang berbeza
Petua untuk penentuan keadaan pengoksidaan:
- Keadaan pengoksidaan satu elemen adalah sifar (ini termasuk molekul yang diperbuat daripada satu elemen tunggal).
- Jumlah caj molekul atau ion adalah jumlah caj setiap atom.
- Keadaan pengoksidaan logam alkali selalu +1, dan untuk logam bumi alkali ia adalah +2.
- Sementara itu, keadaan pengoksidaan fluorin selalu -1.
- Selanjutnya, keadaan pengoksidaan hidrogen biasanya +1. Tetapi kadang -kadang ia adalah -1 (apabila terikat pada logam alkali atau alkali bumi.)
- Juga, secara amnya, keadaan pengoksidaan oksigen adalah -2 (tetapi dalam peroksida dan super -oksida ia mungkin berbeza).
- Atom elektronegatif yang paling dalam molekul mendapat caj negatif, dan yang lain mendapat caj positif.
Keadaan pengoksidaan sangat berguna untuk penentuan produk dalam reaksi redoks. Reaksi redoks adalah tindak balas kimia yang merangkumi pertukaran elektron antara atom. Dalam reaksi redoks, dua reaksi separuh berlaku selari secara serentak. Satu adalah tindak balas pengoksidaan, dan yang lain adalah tindak balas pengurangan. Reaksi pengoksidaan melibatkan peningkatan keadaan pengoksidaan atom, sementara tindak balas pengurangan melibatkan penurunan keadaan pengoksidaan atom.
Apakah perbezaan antara caj rasmi dan keadaan pengoksidaan?
Perbezaan utama antara caj formal dan keadaan pengoksidaan adalah bahawa caj rasmi adalah caj atom dalam molekul yang kita kirakan dengan mengandaikan bahawa elektron dalam ikatan kimia dikongsi sama rata antara atom manakala keadaan pengoksidaan adalah bilangan elektron kehilangan atau keuntungan atom atau berkongsi dengan atom lain. Sebagai contoh, caj rasmi atom nitrogen dalam molekul ammonia adalah 0, manakala keadaan pengoksidaan adalah +3.
Di bawah infographic meringkaskan perbezaan antara caj rasmi dan keadaan pengoksidaan.

Ringkasan -Caj formal vs pengoksidaan
Caj formal dan keadaan pengoksidaan adalah istilah yang berbeza walaupun sesetengah orang menganggap mereka sama. Perbezaan utama antara caj formal dan keadaan pengoksidaan adalah bahawa caj rasmi adalah caj atom dalam molekul yang kita kirakan dengan mengandaikan bahawa elektron dalam ikatan kimia dikongsi sama rata antara atom manakala keadaan pengoksidaan adalah bilangan elektron kehilangan atau keuntungan atom atau berkongsi dengan atom lain.
Rujukan:
1. "2.3: Caj rasmi." Kimia Libreetexts, Libretexts, 25 Julai 2019, boleh didapati di sini.
Ihsan gambar:
1. "Prinsip caj rasmi v.1 "oleh Jü - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Tugasan Negeri Pengoksidaan" oleh Saranphong Yimklan - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


