Perbezaan antara fumarate ferus dan sulfat ferus

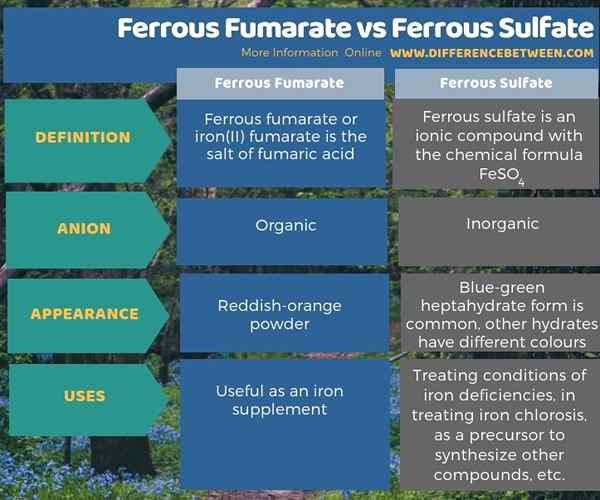
The Perbezaan utama Antara fumarate ferus dan sulfat ferus adalah Dalam fumarate ferrous, anion ferus digabungkan dengan anion organik, manakala dalam sulfat ferus, anion adalah bukan organik.
Besi adalah logam blok D dengan simbol Fe. Ia adalah salah satu elemen yang paling biasa membentuk bumi dan hadir dalam jumlah yang besar di teras dalaman dan luaran bumi. Besi mempunyai keadaan pengoksidaan dari -2 hingga +8. +2 dan borang +3 adalah yang paling biasa di antara ini. +2 Bentuk pengoksidaan besi dikenali sebagai ferrous manakala +3 bentuk dikenali sebagai ferrik. Ion ini dalam bentuk kristal ionik, yang dibentuk dengan pelbagai anion. Selain itu, sulfat fumarate dan ferus ferus adalah dua sebatian ionik yang kami gunakan sebagai suplemen ferus untuk mengatasi kekurangan besi dalam sistem hidup.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu fumarate ferrous
3. Apa itu sulfat ferus
4. Perbandingan sampingan - Ferrous fumarate vs sulfat ferus dalam bentuk jadual
5. Ringkasan
Apa itu fumarate ferrous?
Ferrous fumarate atau besi (ii) fumarate adalah garam asid fumaric. Formula kimia sebatian ini adalah c4H2Feo4, dan ia mempunyai jisim molar 169.9 g/mol. Berikut adalah struktur fumarate ferus.
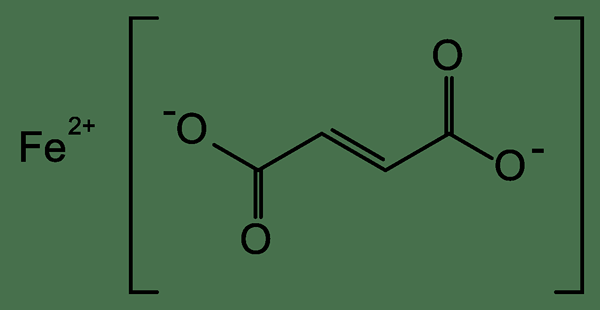
Rajah 01: Struktur kimia fumarate ferus
Ferrous Fumarate adalah serbuk merah-oren. Ia sangat berguna sebagai suplemen besi. Ia mempunyai 32.87% besi per molekul. Ini penting dalam merawat anemia kekurangan besi. Walau bagaimanapun, jika kita mengambilnya dalam jumlah yang besar, akan ada kesan sampingan seperti mengantuk, loya yang teruk atau sakit perut, muntah, cirit -birit berdarah.
Apa itu sulfat ferus?
Ferrous sulfat adalah sebatian ionik dengan formula kimia FESO4. Ia mungkin wujud dalam jenis kristal yang berbeza bergantung kepada bilangan molekul air yang dilampirkan. Ia mempunyai bentuk anhydrous (tiada molekul air yang dilampirkan), serta monohidrat (satu molekul air), tetrahidrat (empat molekul air), pentahydrate (lima molekul air), hexahydrate (enam molekul air). Antaranya, bentuk heptahydrate warna biru-hijau adalah perkara biasa. Bentuk monohidrat, pentahydrate dan hexahydrate agak jarang. Sebagai tambahan kepada kristal warna biru-hijau, bentuk sulfat ferus lain kebanyakannya kristal warna putih. Apabila dipanaskan, kristal terhidrat kehilangan air dan menjadi pepejal anhydrous. Apabila pemanasan lebih lanjut, ia terurai ke dalam sulfur dioksida, sulfur trioksida dan besi (III) oksida (warna merah coklat). Mereka adalah kristal yang tidak berbau.

Rajah 02: Penampilan bentuk heptahydrate sulfat ferus
Ferrous sulfat mudah larut dalam air; Dalam kes itu, ion ferus membentuk kompleks hexaaqua, [fe (h (h (h (h (h (h (h (h (h (h (h (h (h (h (h (h (h (h (h (h2O)6]2+. Selain itu, sebatian ini berguna dalam merawat keadaan kekurangan besi seperti anemia kekurangan zat besi. Ia juga boleh ditambah kepada tumbuhan, juga, i.e. Dalam keadaan seperti klorosis besi di mana daun tumbuhan menjadi kuning, warna pucat feros diberikan. Di samping itu, penting sebagai pendahulu untuk mensintesis sebatian lain. Selain itu, kita boleh menggunakannya sebagai ejen pengurangan dalam reaksi redoks.
Apakah perbezaan antara fumarate ferus dan sulfat ferus?
Kedua -dua fumarate ferus dan sulfat ferus penting kerana suplemen besi. Perbezaan utama antara fumarate ferus dan sulfat ferus adalah bahawa dalam anion ferus ferus ferus digabungkan dengan anion organik semasa dalam sulfat ferus, anion adalah bukan organik. Ferus Fumarate muncul sebagai serbuk merah-oren manakala bentuk hidrat sulfat ferus mempunyai warna yang berbeza. Walau bagaimanapun, bentuk sulfat ferus yang paling biasa adalah bentuk heptahydrate, dan ia muncul dalam warna biru-hijau.
Ringkasan -Ferrous Fumarate vs Ferrous Sulfate
Kedua -dua fumarate ferus dan sulfat ferus penting kerana suplemen besi. Perbezaan utama antara fumarate ferus dan sulfat ferus ialah, dalam fumarate ferus, anion ferus digabungkan dengan anion organik, manakala dalam sulfat ferus, anion adalah bukan organik.
Rujukan:
1. "Besi (ii) Fumarate."Wikipedia, Yayasan Wikimedia, 17 Mei 2019, boleh didapati di sini.
Ihsan gambar:
1. "Besi (II) Fumarate" oleh Ilgom - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Sulfat Ferrous" oleh W. OELEN - (CC BY -SA 3.0) melalui Commons Wikimedia


