Perbezaan antara ikatan electrovalent dan kovalen
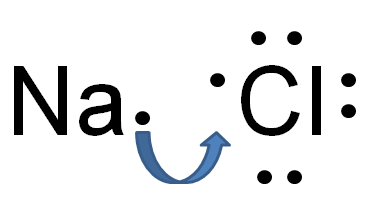
Perbezaan utama antara ikatan electrovalent dan kovalen ialah ikatan elektrovalen berlaku dengan memindahkan elektron dari satu atom ke yang lain sedangkan ikatan kovalen berlaku akibat perkongsian elektron valensi antara atom. Ikatan ionik juga dipanggil ikatan elektrovalen. Elektron valensi, yang merupakan elektron yang terletak di kerang paling luar atom, terlibat dalam kedua -dua jenis ikatan kimia.
Ikatan kimia adalah kunci untuk membentuk pelbagai jenis sebatian kimia. Ia bertindak sebagai gam untuk memegang atom atau molekul bersama. Tujuan utama ikatan kimia adalah untuk menghasilkan sebatian kimia yang stabil. Apabila bentuk ikatan kimia, tenaga dilepaskan, membentuk sebatian yang stabil. Terdapat tiga jenis utama ikatan kimia yang dikenali sebagai ikatan ionik, ikatan kovalen, dan ikatan logam atau bukan kovalen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu ikatan elektrovalen
3. Apa itu ikatan kovalen
4. Perbandingan sampingan - Bon Electrovalent vs Covalent
5. Ringkasan
Apa itu ikatan elektrovalen?
Electrovalent atau Ionic Bond adalah jenis ikatan kimia yang dibentuk sebagai hasil daripada memindahkan elektron dari satu atom ke yang lain. Pemindahan ini menyebabkan satu atom mendapat caj positif dan atom lain mendapat bayaran negatif. Atom penderma elektron menjadi positif; Oleh itu, ia dipanggil kation sedangkan, atom yang menerima elektron menjadi negatif dan dipanggil anion. Daya tarikan elektrostatik timbul antara kation dan anion ini kerana caj elektrik yang bertentangan. Perbezaan besar dalam elektronegativiti antara kedua -dua atom menyebabkan ikatan ini berlaku. Kedua-dua atom logam dan bukan logam terlibat dalam ikatan ini.
Walau bagaimanapun, tiada ikatan elektrovalen adalah ikatan ionik tulen. Setiap sebatian ionik mungkin mempunyai beberapa peratusan ikatan kovalen. Oleh itu, ia mendedahkan bahawa sebatian ionik mempunyai watak ionik yang lebih besar dan tahap kovalen yang rendah. Tetapi terdapat beberapa sebatian dengan tahap kovalen yang cukup. Jenis ikatan itu dipanggil ikatan kovalen kutub.
Ciri -ciri sebatian yang dibina dari ikatan elektrovalen berbeza dari sebatian yang dibina dari ikatan kovalen. Apabila mempertimbangkan sifat fizikal, titik mendidih yang lebih tinggi dan titik lebur dapat diperhatikan. Tetapi kelarutan dalam air dan harta kekonduksian elektrik sangat tinggi. Contoh sebatian dengan ikatan ionik mungkin termasuk halida logam, oksida logam, sulfida logam, dll.
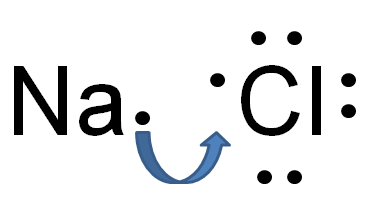
Rajah 01: Ikatan Electrovalent
Apa itu ikatan kovalen?
Ikatan kovalen adalah sejenis ikatan kimia yang dibentuk sebagai hasil daripada berkongsi pasangan elektron antara atom bukan logam. Perkongsian elektron ini berlaku disebabkan oleh perbezaan elektronegativiti yang rendah antara kedua -dua atom yang terlibat dalam ikatan. Dalam ikatan kovalen, atom bukan logam biasanya terlibat. Atom -atom ini mempunyai konfigurasi elektron yang tidak lengkap di orbital luarnya, oleh itu, berkongsi elektron yang tidak berpasangan untuk mencapai konfigurasi elektron yang serupa dengan gas mulia. Itu kerana konfigurasi elektron yang tidak lengkap menjadikan atom tertentu tidak stabil. Tidak seperti ikatan ionik, ikatan kovalen mungkin mempunyai ikatan tunggal, berganda atau ikatan tiga di antara dua atom. Ikatan ini terbentuk sedemikian rupa sehingga kedua -dua atom mematuhi peraturan oktet. Ikatan berlaku melalui tumpang tindih orbital atom. Satu ikatan terbentuk apabila dua elektron dikongsi. Ikatan berganda dibentuk apabila empat elektron dikongsi. Perkongsian enam elektron boleh mengakibatkan ikatan tiga.
Ciri -ciri sebatian dengan ikatan kovalen termasuk ikatan yang kuat antara dua atom kerana nilai elektronegativiti yang serupa. Oleh itu, kelarutan dan kekonduksian elektrik (dalam keadaan larut) adalah miskin atau tidak hadir. Sebatian ini juga mempunyai titik lebur yang lebih rendah dan titik mendidih berbanding dengan sebatian ionik. Sejumlah sebatian organik dan bukan organik boleh diambil sebagai contoh sebatian dengan ikatan kovalen.
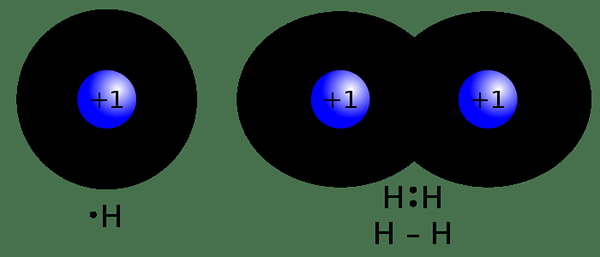
Rajah 02: ikatan kovalen
Apakah perbezaan antara ikatan elektrovalen dan ikatan kovalen?
Bon Electrovalent vs Bond Kovalen | |
| Ikatan elektrovalen adalah ikatan kimia antara dua atom kerana pemindahan elektron dari satu atom ke yang lain. | Ikatan kovalen adalah jenis ikatan kimia yang berlaku disebabkan oleh perkongsian pasangan elektron antara atom. |
| Logam vs bukan logam | |
| Bon elektrodvalen dapat dilihat antara logam dan bukan logam. | Bon kovalen biasanya dapat diperhatikan di antara dua bukan logam. |
| Perbezaan dalam elektronegativiti | |
| Perbezaan elektronegativiti antara dua atom adalah lebih tinggi dalam ikatan elektrovalen. | Perbezaan elektronegativiti antara dua atom adalah lebih rendah. |
| Kelarutan dalam kekonduksian air dan elektrik | |
| Kelarutan dalam kekonduksian air dan elektrik lebih tinggi dalam sebatian dengan ikatan elektrovalen. | Kelarutan dalam kekonduksian air dan elektrik agak rendah dalam sebatian dengan ikatan kovalen. |
| Mata mendidih dan lebur | |
| Titik mendidih dan lebur lebih tinggi untuk ikatan elektroden. | Titik mendidih dan lebur agak rendah untuk ikatan kovalen. |
Ringkasan -Electrovalent vs Bond Covalent
Bon Electrovalent dan Covalent adalah dua jenis ikatan kimia yang berbeza antara satu sama lain. Perbezaan utama antara ikatan electrovalent dan kovalen adalah sifat mereka; Bond Electrovalent adalah sejenis tarikan elektrostatik antara dua atom manakala ikatan kovalen adalah perkongsian pasangan elektron antara dua atom.
Rujukan:
1. "Ikatan Electrovalent."EmedicalPrep. N.p., n.d. Web. 25 Mei 2017.<>
2."Ikatan kovalen ."Kumpulan Bahagian Pendidikan Kimia. Universiti Purdue, n.d. Web. 25 Mei 2017.<>
3."Ikatan kimia."Akademi Khan, n.d. Web. 25 Mei 2017. <>
Ihsan gambar:
1. "NaCl Ionic Bond" oleh Mhowison - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Hidrogen Bond Covalent" oleh Jacek FH - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


