Perbezaan antara electrovalency dan covalency
The Perbezaan utama antara electrovalency dan covalency adalah bahawa Electrovalency adalah bilangan elektron yang atom sama ada keuntungan atau kerugian dalam membentuk ion manakala covalency adalah bilangan elektron yang dapat dikongsi oleh atom dengan atom lain.
Walaupun istilah elektrovalensi dan kovalensi terdengar serupa, mereka berbeza antara satu sama lain mengikut definisi mereka. Terutamanya, elektrovalensi menerangkan pembentukan ion manakala kovalensi menerangkan pembentukan ikatan kovalen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Electrovalency
3. Apa itu covalency
4. Perbandingan sampingan - Electrovalency vs covalency dalam bentuk jadual
5. Ringkasan
Apa itu Electrovalency?
Elektrovalensi adalah bilangan elektron yang diperoleh atau hilang semasa pembentukan ion dari atom itu. Oleh itu, ia merujuk kepada bilangan elektron bahawa atom sama ada keuntungan atau kerugian ketika membentuk ikatan elektrovalen, kita menyebutnya ikatan ionik. Mengikut penjelasan ini, ia memberikan caj elektrik bersih pada ion. Lebih -lebih lagi, jika atom kehilangan elektron apabila membentuk ikatan ionik menunjukkan elektrovalensi positif sementara jika atom memperoleh elektron apabila membentuk ikatan ionik, ia menunjukkan bahawa atom mempunyai elektroden negatif. Sebatian dengan atom yang mempunyai elektrovalensi adalah sebatian ionik.

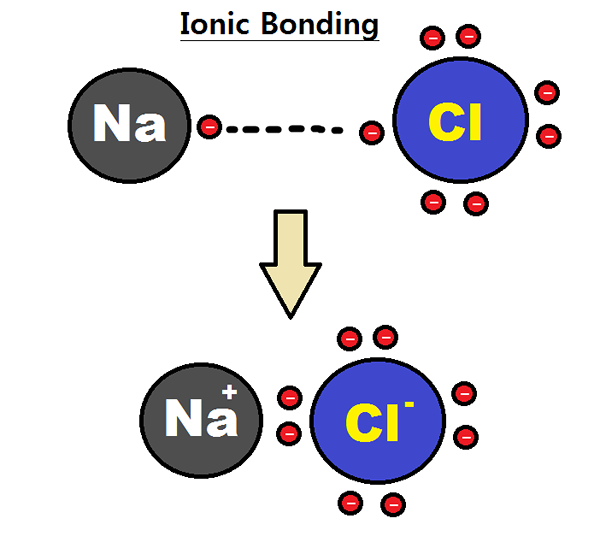
Rajah 01: Pembentukan ikatan ionik
Sebagai contoh, mari kita pertimbangkan pembentukan natrium klorida (NaCl). Di sana, atom natrium kehilangan satu elektron; Oleh itu, ia mempunyai elektrovalensi positif. Atom klorin memperoleh elektron itu. Oleh itu, ia mempunyai elektroditi negatif. Walau bagaimanapun, kerana bilangan elektron yang hilang atau diperolehi adalah satu, elektrovalensi natrium (atau klorin) adalah satu. Kita harus memberikan elektrovalensi dengan nafas yang sesuai untuk menunjukkan sama ada ia adalah elektroditi positif atau negatif.
- Natrium = Natrium Elektrovalensi Positif boleh diberikan sebagai +1.
- Klorin = Electrovalency negatif klorin boleh diberikan sebagai -1.
Apa itu covalency?
Covalency adalah bilangan maksimum elektron yang dapat dikongsi dengan atom lain. Oleh itu, ia menunjukkan bilangan maksimum ikatan kovalen yang dapat dibentuk oleh atom menggunakan orbital kosongnya. Nilai parameter ini bergantung kepada bilangan elektron valensi atom dan bilangan orbital kosong yang terdapat dalam atom.
Sebagai contoh, atom hidrogen hanya mempunyai satu elektron; Oleh itu, ia dapat berkongsi satu elektron dengan atom lain. Oleh itu, kovalensi hidrogen adalah 1. Tidak seperti dalam electrovalency, kita tidak memerlukan tanda tambah atau tolak kerana tidak ada kerugian atau keuntungan elektron; Hanya elektron yang dikongsi antara satu sama lain.
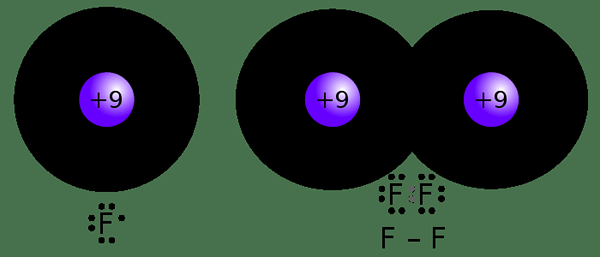
Rajah 02: Pembentukan ikatan kovalen
Seperti yang kita nyatakan di atas, bukan sahaja bilangan elektron valensi tetapi juga bilangan orbital kosong atom adalah penting dalam menentukan kovalensi. Sebagai contoh, jika kita menganggap karbon sebagai contoh, ia mempunyai 4 elektron dalam cangkang elektron paling luar. Di sana, ia mempunyai 2s22p2 konfigurasi elektron. Oleh itu, terdapat orbital 2p kosong. Oleh itu, kedua -dua elektron berpasangan di orbital 2s boleh dipisahkan, dan satu elektron dimasukkan ke dalam orbital 2p kosong. Kemudian terdapat 4 elektron yang tidak berpasangan. Karbon boleh berkongsi empat elektron dengan atom lain. Oleh itu, kovalen menjadi 4. Ini kerana apabila kita menulis konfigurasi elektron karbon, kita lihat hanya terdapat 2 elektron yang tidak berpasangan, jadi kita fikir kovalensi karbon adalah 2 ketika sebenarnya 4.
Apakah perbezaan antara electrovalency dan covalency?
Elektrovalensi adalah bilangan elektron yang diperoleh atau hilang semasa pembentukan ion dari atom itu. Ia menerangkan pembentukan ikatan ionik. Selain itu, sebatian yang mempunyai atom dengan parameter ini adalah sebatian ionik. Sebaliknya, kovalensi adalah bilangan maksimum elektron yang dapat dikongsi dengan atom lain. Ia menerangkan pembentukan ikatan kovalen. Di samping itu, sebatian yang mempunyai atom dengan kovalensi adalah sebatian kovalen.
Infographic di bawah membentangkan perbezaan antara electrovalency dan covalency dalam bentuk jadual.

Ringkasan -Electrovalency vs Covalency
Walaupun istilah elektrovalensi dan kovalensi terdengar serupa, mereka mempunyai definisi dan ciri yang berbeza. Perbezaan antara elektrovalensi dan kovalensi adalah bahawa elektrodi adalah bilangan elektron yang ada atom sama ada keuntungan atau kerugian dalam membentuk ion sedangkan kovalensi adalah bilangan elektron yang dapat dikongsi oleh atom dengan atom lain.
Rujukan:
1. "2. Idea asas ikatan."Peranan PH dalam Kimia Kehidupan Seharian. Terdapat di sini
2. "Kimia-Kovalensi dan Struktur Molekul."Penyelidikan masa tindak balas sistem biologi-saraf. Terdapat di sini
Ihsan gambar:
1."Ionicbondingrh11" oleh Rhannosh - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia
2."Fluorine Bond Covalent" oleh Jacek FH - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia


