Perbezaan antara ikatan kovalen dan ikatan datif
The Perbezaan utama antara ikatan kovalen dan ikatan datif ialah ikatan kovalen membentuk apabila elektron yang tidak berpasangan dari dua atom bersekutu antara satu sama lain manakala ikatan datif membentuk apabila atom menyumbangkan salah satu pasangan elektronnya ke atom lain.
Walaupun ikatan datif kelihatan seperti ikatan kovalen, mereka berbeza antara satu sama lain apabila kita menganggap pembentukan ikatan. Tetapi, tidak ada perbezaan antara ikatan kovalen dan ikatan datif selepas pembentukannya. Oleh itu, kita biasanya memanggil ikatan dative sebagai ikatan kovalen, yang tidak salah.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu ikatan kovalen
3. Apa itu ikatan Dative
4. Perbandingan sampingan - ikatan kovalen vs ikatan datif dalam bentuk jadual
5. Ringkasan
Apa itu ikatan kovalen?
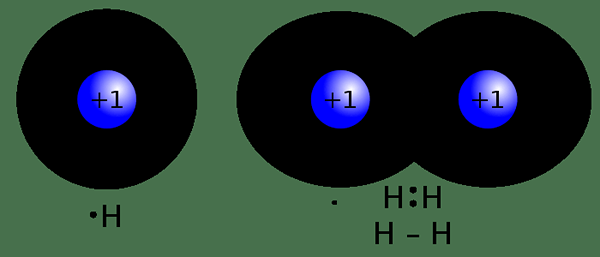
Ikatan kovalen adalah bentuk ikatan kimia yang terbentuk apabila dua atom berkongsi pasangan elektron. Kami menyebutnya sebagai "ikatan molekul". Elektron yang dikongsi adalah "pasangan bersama" atau "pasangan ikatan". Ikatan kovalen yang dibentuk kerana keseimbangan stabil daya menarik dan menjijikkan antara atom apabila mereka berkongsi elektron. Perkongsian elektron ini membolehkan setiap atom mempunyai setara dengan cangkang luar penuh. Jenis bon ini membentuk antara dua atom bukan logam yang mempunyai nilai elektronegativiti hampir sama atau antara elektron dan ion logam yang positif.

Rajah 01: Pembentukan ikatan kovalen antara dua atom hidrogen
Bon kovalen adalah terutamanya daripada dua jenis; mereka adalah ikatan kutub dan ikatan nonpolar. Ikatan kutub wujud di antara dua atom dengan perbezaan antara nilai elektronegativiti mereka dalam julat 0.4 hingga 1.7. Bentuk bon nonpolar jika perbezaan ini lebih rendah daripada 0.4. Ini kerana, perbezaan yang tinggi antara nilai elektronegativiti bermakna, satu atom (mempunyai nilai elektronegativiti yang lebih tinggi) menarik elektron lebih daripada atom lain yang membuat ikatan, kutub.
Terdapat tiga jenis ikatan kovalen utama mengikut bilangan pasangan elektron yang dikongsi antara dua atom. Mereka adalah ikatan tunggal yang melibatkan satu pasangan elektron, ikatan berganda yang melibatkan dua pasangan elektron, dan ikatan triple yang melibatkan tiga pasangan elektron.
Apa itu ikatan Dative?
Ikatan datif adalah sejenis ikatan kovalen yang membentuk apabila satu atom mendermakan pasangan elektronnya ke atom lain. Selepas pembentukan ikatan, ia kelihatan seperti ikatan kovalen. Ini kerana kedua -dua atom berkongsi pasangan elektron yang sama dengan pasangan bon.
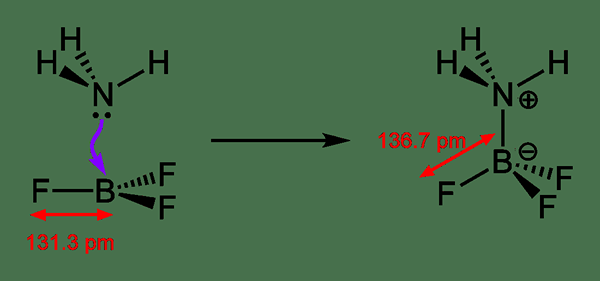
Rajah 02: Pembentukan ikatan datif
Sinonim untuk ikatan ini adalah "ikatan dipolar" dan "koordinat ikatan". Contoh yang paling biasa ialah bon dalam kompleks koordinasi. Di sana, ion logam mengikat dengan ligan melalui bon koordinat ini.
Apakah perbezaan antara ikatan kovalen dan ikatan datif?
Ikatan kovalen adalah bentuk ikatan kimia yang terbentuk apabila dua atom berkongsi pasangan elektron. Ikatan datif adalah sejenis ikatan kovalen yang membentuk apabila satu atom mendermakan pasangan elektronnya ke atom lain. Mereka berbeza antara satu sama lain mengikut cara mereka membentuk. Oleh itu, perbezaan utama antara ikatan kovalen dan ikatan datif adalah bahawa ikatan kovalen membentuk apabila elektron yang tidak berpasangan dari dua atom bersekutu antara satu sama lain manakala bentuk ikatan datif apabila atom menyumbangkan salah satu pasangan elektronnya ke atom lain.
Infographic di bawah membentangkan perbezaan antara ikatan kovalen dan ikatan datif dalam bentuk jadual.
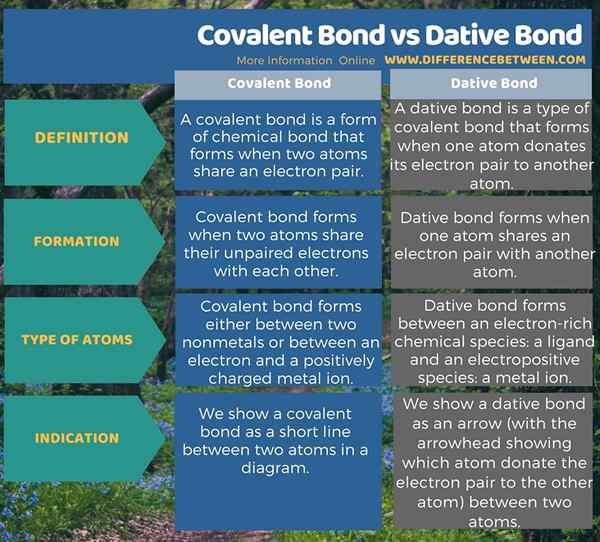
Ringkasan -ikatan kovalen vs ikatan dative
Selepas pembentukan ikatan, kedua -dua ikatan kovalen dan ikatan dative nampaknya serupa. Walau bagaimanapun, mereka berbeza antara satu sama lain mengikut cara mereka membentuk. Perbezaan antara ikatan kovalen dan ikatan datif ialah bentuk ikatan kovalen apabila elektron yang tidak berpasangan dari dua atom bersekutu antara satu sama lain sedangkan bentuk ikatan datif apabila atom menyumbangkan salah satu pasangan elektronnya ke atom lain.
Rujukan:
1. Helmenstine, Anne Marie, PH.D. "Definisi bon kovalen."Pemikiran, Jun. 22, 2018. Terdapat di sini
2. Helmenstine, Anne Marie, PH.D. "Definisi bon datif (bon koordinat)."Pemikiran, Jun. 22, 2018. Terdapat di sini
Ihsan gambar:
1."Hidrogen Bond Covalent" oleh Jacek FH - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia
2."NH3-BF3-Adduct-Bond-Leftening-2D" oleh Ben Mills-Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia


