Perbezaan antara elektronegativiti dan polariti
The Perbezaan utama antara elektronegativiti dan polaritas ialah elektronegativiti adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arahnya, sedangkan polaritas bermaksud pemisahan caj.
Polariti timbul kerana perbezaan elektronegativiti. Oleh itu, kedua -dua istilah ini adalah istilah yang berkait rapat. Walau bagaimanapun, terdapat perbezaan yang berbeza antara elektronegativiti dan polariti. Salah satu perbezaan antara elektronegativiti dan polaritas ialah elektronegativiti menggambarkan daya tarikan di peringkat atom manakala polariti menggambarkan daya tarikan di peringkat molekul.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah elektronegativiti
3. Apa itu polar
4. Perbandingan sampingan - Elektronegativiti vs polariti dalam bentuk jadual
5. Ringkasan
Apakah elektronegativiti?
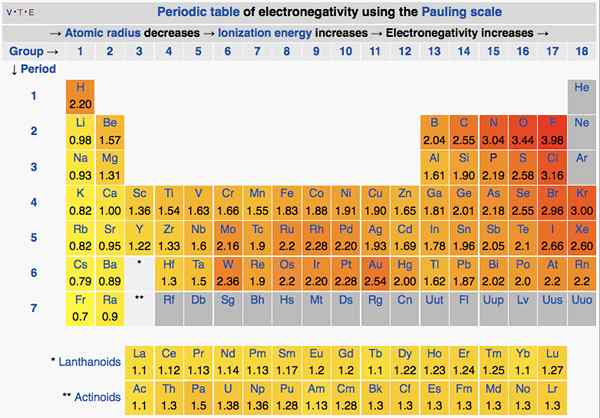
Elektronegativiti adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arah itu. Pada asasnya, ini menunjukkan "rupa" atom ke arah elektron. Kita boleh menggunakan skala Pauling untuk menunjukkan elemen elemen.
Dalam jadual berkala, elektronegativiti berubah mengikut corak. Dari kiri ke kanan, pada suatu tempoh, elektronegativiti meningkat. Dari atas ke bawah, pada kumpulan, elektronegativiti berkurangan. Oleh itu, fluorin adalah elemen paling elektronegatif dengan nilai 4.0 pada skala Pauling. Kumpulan satu dan dua elemen mempunyai kurang elektronegativiti; Oleh itu, mereka cenderung membentuk ion positif dengan memberi elektron. Oleh kerana kumpulan 5, 6, 7 elemen mempunyai nilai elektronegativiti yang lebih tinggi, mereka suka mengambil elektron dan dari ion negatif.

Rajah 01: Elektronegativiti unsur -unsur dalam jadual berkala
Elektronegativiti juga penting dalam menentukan sifat ikatan. Sekiranya kedua -dua atom dalam ikatan tidak mempunyai perbezaan elektronegativiti, maka ikatan kovalen akan membentuk. Sekiranya perbezaan elektronegativiti antara keduanya tinggi, maka ikatan ionik akan terbentuk.
Apa itu polar?
Polariti timbul kerana perbezaan elektronegativiti atom. Apabila dua atom atau atom yang sama mempunyai elektronegativiti yang sama membentuk ikatan di antara mereka, atom -atom ini menarik pasangan elektron dengan cara yang sama. Oleh itu, mereka cenderung untuk berkongsi elektron, dan bon nonpolar semacam ini dikenali sebagai ikatan kovalen. Walau bagaimanapun, apabila kedua -dua atom itu berbeza, elektronegativiti mereka sering berbeza. Tetapi tahap perbezaan mungkin lebih tinggi atau lebih rendah. Oleh itu, pasangan elektron terikat ditarik lebih banyak oleh satu atom berbanding atom lain yang mengambil bahagian dalam membuat ikatan. Oleh itu, ia akan mengakibatkan pengagihan elektron yang tidak sama rata antara kedua -dua atom. Selain itu, jenis ikatan kovalen ini dikenali sebagai ikatan kutub.
Kerana perkongsian elektron yang tidak sekata, satu atom akan mempunyai caj yang sedikit negatif, sedangkan atom lain akan mempunyai caj yang sedikit positif. Pada masa ini, kita mengatakan bahawa atom telah memperoleh caj positif negatif atau separa separa. Atom dengan elektronegativiti yang lebih tinggi mendapat caj negatif separa, dan atom dengan elektronegativiti yang lebih rendah akan mendapat caj positif separa. Polariti merujuk kepada pemisahan caj. Molekul ini mempunyai momen dipole.
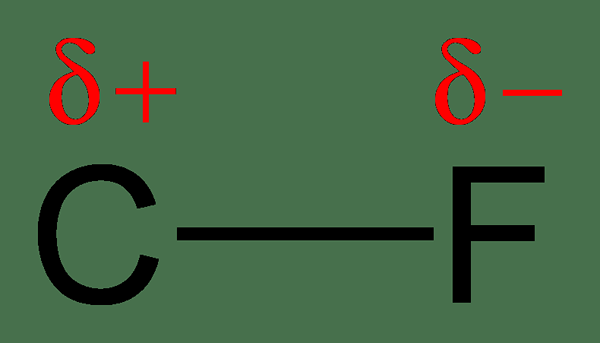
Rajah 2: Pemisahan caj dalam ikatan C-F; Fluorin lebih elektronegatif daripada karbon
Dalam molekul, terdapat sekurang -kurangnya satu ikatan atau lebih. Sebilangan ikatan adalah kutub manakala ada yang bukan kutub. Untuk molekul menjadi kutub, semua bon harus secara kolektif menghasilkan pengagihan caj yang tidak sekata dalam molekul.
Molekul kutub
Tambahan pula, molekul mempunyai geometri yang berbeza, jadi pengedaran bon juga menentukan polaritas molekul. Sebagai contoh, hidrogen klorida adalah molekul kutub dengan hanya satu ikatan. Molekul air adalah molekul kutub dengan dua ikatan. Momen dipole dalam molekul ini kekal kerana mereka telah timbul kerana perbezaan elektronegativiti. Tetapi, ada molekul lain yang boleh menjadi kutub hanya pada masa -masa tertentu. Molekul dengan dipole tetap boleh menyebabkan dipole dalam molekul bukan kutub yang lain, maka itu juga akan menjadi molekul kutub sementara. Walaupun dalam molekul, perubahan tertentu boleh menyebabkan momen dipole sementara.
Apakah perbezaan antara elektronegativiti dan polariti?
Elektronegativiti adalah ukuran kecenderungan atom untuk menarik sepasang elektron ikatan sementara polaritas adalah harta yang mempunyai kutub atau kutub. Oleh itu, perbezaan utama antara elektronegativiti dan polaritas adalah bahawa elektronegativiti adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arahnya, sedangkan polaritas adalah pemisahan caj.
Selain itu, perbezaan tambahan antara elektronegativiti dan polariti adalah bahawa elektronegativiti menggambarkan daya tarikan di peringkat atom manakala polariti menggambarkan daya tarikan di peringkat molekul. Oleh itu, tarikan antara nukleus atom dan elektron paling luar adalah sebab atom mempunyai nilai elektronegativiti; Oleh itu, ia menentukan nilai elektronegativiti. Tetapi, polariti disebabkan oleh pemisahan caj dalam ikatan kerana perbezaan nilai elektronegativiti atom.
Di bawah infographic menunjukkan lebih banyak maklumat mengenai perbezaan antara elektronegativiti dan polariti.
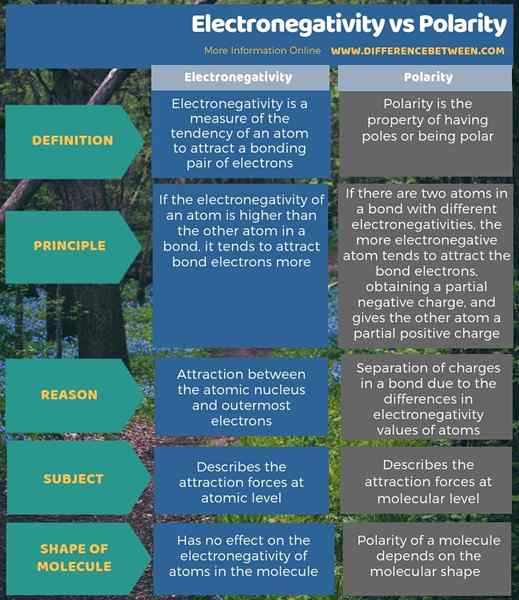
Ringkasan -Elektronegativiti vs polaritas
Elektronegativiti dan polariti adalah istilah yang berkaitan; Elektronegativiti atom dalam molekul menentukan polaritas molekul. Perbezaan utama antara elektronegativiti dan polaritas ialah elektronegativiti adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arahnya, sedangkan polaritas bermaksud pemisahan caj.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi dan contoh elektronegativiti."Thoughtco, Oct. 17, 2018, boleh didapati di sini.
Ihsan gambar:
1. "Jadual Berkala Pauling Electronegatvity" oleh DMACKS - (CC BY -SA 3.0) melalui Commons Wikimedia
2. "Karbon-Fluorine-Bond-Polarity-2D" oleh Ben Mills-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


