Perbezaan antara ikatan kovalen dan bukan kovalen
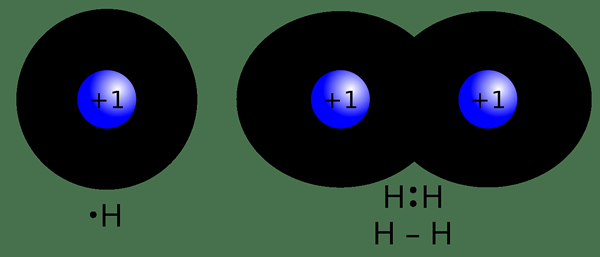
The Perbezaan utama antara ikatan kovalen dan non -kovalen ialah ikatan kovalen membentuk apabila dua atom berkongsi elektron mereka antara satu sama lain manakala ikatan bukan kovalen membentuk sama ada dengan menukar sepenuhnya elektron antara dua atom atau dengan tidak bertukar -tukar mana -mana elektron.
Terdapat empat jenis utama ikatan kimia: ikatan kovalen, ikatan ionik, ikatan hidrogen, dan interaksi van der Waals. Apabila kita mengkategorikan ikatan kimia sebagai ikatan kovalen dan nonkovalen, ikatan ionik, hidrogen, dan interaksi van der Waals berada di bawah kategori ikatan noncovalent.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah ikatan kovalen
3. Apakah ikatan bukan kovalen
4. Perbandingan sampingan - kovalen vs ikatan noncovalent dalam bentuk jadual
5. Ringkasan
Apakah ikatan kovalen?
Ikatan kovalen adalah sejenis ikatan kimia yang terbentuk apabila dua atom berkongsi pasangan elektron di antara mereka. Ia dinamakan sebagai "ikatan molekul". Bon ini terbentuk apabila "pasangan bersama" atau "pasangan ikatan" wujud antara atom. Bentuk ikatan kovalen kerana keseimbangan stabil daya menarik dan menjijikkan antara atom ketika mereka berkongsi elektron. Berkongsi elektron antara atom membolehkan setiap atom mempunyai setara dengan cangkang luar penuh. Biasanya, jenis bon ini membentuk antara dua atom bukan logam yang mempunyai nilai elektronegativiti hampir sama atau antara elektron dan ion logam yang positif.

Terdapat dua jenis utama ikatan kovalen: ikatan kovalen kutub dan ikatan kovalen nonpolar. Ikatan kovalen kutub wujud di antara dua atom dengan perbezaan antara nilai elektronegativiti mereka dalam julat 0.4 hingga 1.7. Bond Bond Nonpolar Covalent Jika perbezaan ini lebih rendah daripada 0.4. Di sini, perbezaan yang tinggi antara nilai elektronegativiti bermakna, satu atom (mempunyai nilai elektronegativiti yang lebih tinggi) menarik elektron lebih daripada atom lain, menjadikan kutub ikatan.
Menurut bilangan pasangan elektron yang dikongsi antara dua atom, kita dapat mengenal pasti tiga jenis utama ikatan kovalen sebagai ikatan tunggal, yang melibatkan satu pasangan elektron, ikatan berganda, yang melibatkan dua pasangan elektron, dan ikatan triple, yang melibatkan tiga pasangan elektron.
Apakah ikatan bukan kovalen?
Ikatan noncovalent adalah ikatan kimia yang terbentuk sama ada dengan menukar sepenuhnya elektron antara atom atau dengan tidak bertukar elektron sama sekali. Terdapat tiga jenis ikatan bukan kovalen sebagai ikatan ionik, ikatan hidrogen, dan interaksi van der Waals.
Atom boleh mendapatkan atau kehilangan elektron dan membentuk zarah yang negatif atau positif untuk mendapatkan konfigurasi elektron yang stabil. Kami memanggil zarah -zarah ini "ion". Mereka mempunyai interaksi elektrostatik di antara mereka. Ikatan ionik dapat digambarkan sebagai daya tarikan antara ion -ion yang bertentangan ini. Interaksi elektrostatik antara ion dipengaruhi oleh elektronegativiti atom dalam ikatan ionik. Oleh itu, elektronegativiti memberikan pengukuran pertalian atom untuk elektron. Atom dengan elektronegativiti yang tinggi dapat menarik elektron dari atom dengan elektronegativiti yang rendah untuk membentuk ikatan ionik.

Ikatan hidrogen adalah ikatan bukan kovalen yang lain. Ia adalah jenis daya tarikan antara dua atom dari dua molekul yang berbeza yang merupakan daya tarikan yang lemah. Walau bagaimanapun, apabila membandingkan dengan jenis daya intramolekul yang lain seperti interaksi polar polar, interaksi nonpolar-nonpolar seperti daya vander waal, ikatan hidrogen lebih kuat. Biasanya, ikatan hidrogen terbentuk antara molekul kovalen kutub. Molekul -molekul ini mengandungi ikatan kovalen kutub, yang terbentuk sebagai hasil daripada perbezaan nilai elektronegativiti atom -atom yang berada dalam ikatan kovalen.
Interaksi van der Waals adalah satu lagi jenis ikatan bukan kovalen. Mereka adalah daya tarikan yang lemah di antara dua atom dalam dua molekul nonpolar. Interaksi van der Waals sama ada daya tarikan atau penolakan yang disebabkan oleh korelasi dalam polarisasi yang berubah -ubah dari zarah berdekatan.
Apakah perbezaan antara ikatan kovalen dan bukan kovalen?
Ikatan kovalen dan nonkovalen adalah dua kelas luas ikatan kimia dalam kimia. Bon kovalen boleh didapati dalam tiga subkumpulan lagi sebagai ikatan ionik, ikatan hidrogen, dan interaksi van der Waals. Perbezaan utama antara ikatan kovalen dan non -kovalen ialah bentuk ikatan kovalen apabila dua atom berkongsi elektron mereka antara satu sama lain manakala ikatan non -kovalen membentuk sama ada dengan menukar sepenuhnya elektron antara dua atom atau tidak bertukar mana -mana elektron.
Di bawah Infographic menyenaraikan perbezaan antara ikatan kovalen dan bukan kovalen dengan lebih terperinci.

Ringkasan -Kovalen vs ikatan non -kovalen
Ikatan kovalen dan nonkovalen adalah dua kelas luas ikatan kimia dalam kimia. Bon kovalen boleh didapati dalam tiga subkumpulan lagi sebagai ikatan ionik, ikatan hidrogen, dan interaksi van der Waals. Perbezaan utama antara ikatan kovalen dan non -kovalen ialah bentuk ikatan kovalen apabila dua atom berkongsi elektron mereka antara satu sama lain manakala ikatan non -kovalen membentuk sama ada dengan menukar sepenuhnya elektron antara dua atom atau tidak bertukar mana -mana elektron.
Rujukan:
1. "Van der Waals memaksa."Kimia Libretexts, Libretexts, 15 Ogos. 2020, boleh didapati di sini.
Ihsan gambar:
1. "Hidrogen Bond Covalent" oleh Jacek FH - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia
2. "Ikatan Ionik" oleh Jayron32.bercakap.Sumbangan - Saya mencipta kerja ini sepenuhnya sendiri. (CC BY-SA 3.0) melalui Commons Wikimedia


