Perbezaan antara perencatan yang kompetitif dan tidak kompetitif
Perbezaan utama - Kompetitif vs perencatan yang tidak kompetitif
Tindakan inhibitor boleh didapati dalam dua jenis sebagai inhibitor kompetitif dan inhibitor yang tidak kompetitif berdasarkan tempat di enzim di mana perencat mengikat. Perbezaan utama antara perencatan kompetitif dan perencatan yang tidak kompetitif ialah Dalam perencatan yang kompetitif, pengikatan perencat menghalang pengikatan molekul sasaran dengan tapak aktif enzim sedangkan, dalam perencatan yang tidak kompetitif, perencat mengurangkan aktiviti enzim.
Enzim adalah makromolekul yang boleh bertindak sebagai pemangkin biologi. Enzim mempunyai kawasan yang dikenali sebagai tapak aktif. Tapak aktif enzim adalah lokasi di mana molekul sasaran mengikat. Molekul ini dikenali sebagai substrat. Substrat mengikat dengan tapak aktif dan menjalani tindak balas kimia. Ini memberikan hasil maksimum pada masa yang singkat. Enzim juga boleh dikitar semula dan digunakan semula. Inhibitor adalah sebatian yang dapat menghalang substrat daripada menjalani tindak balas kimia tertentu.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah perencatan yang kompetitif
3. Apakah perencatan yang tidak kompetitif
4. Perbandingan sampingan - Kompetitif vs perencatan yang tidak kompetitif dalam bentuk jadual
5. Ringkasan
Apakah perencatan yang kompetitif?
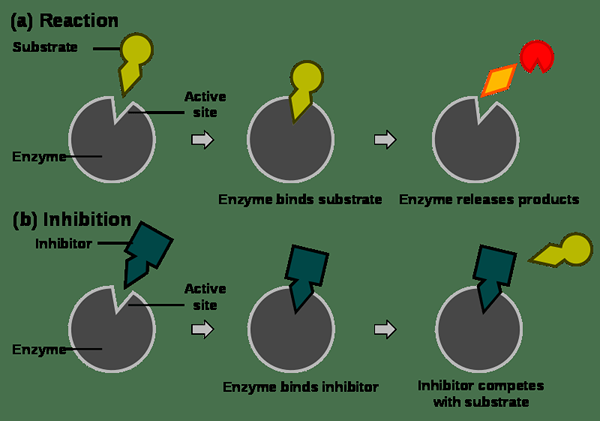
Perencatan yang kompetitif adalah sejenis perencatan enzim di mana perencat mengikat ke tapak aktif enzim, menghalang substrat dari mengikat ke enzim. Tapak aktif disekat oleh perencat, jadi tidak ada ruang untuk substrat untuk mengikat enzim.
Dalam jenis perencatan ini, inhibitor yang terikat ke tapak aktif adalah serupa dengan bentuk molekul substrat (jika tidak, inhibitor tidak dapat mengikat dengan tapak aktif kerana bentuk tapak aktif tidak sesuai dengan bentuk substrat ). Oleh itu, tapak aktif enzim tidak dapat mengikat dengan kedua -dua perencat dan substrat pada masa yang sama. Ini menjadikan perencat untuk bersaing dengan substrat untuk mengikat ke tapak aktif, yang memberikan nama perencatan yang kompetitif.

Rajah 01: Perencatan kompetitif dalam rajah
Perencatan yang kompetitif dapat dicegah dengan menambahkan banyak molekul substrat. Ini meningkatkan kebarangkalian laman web aktif memenuhi substrat daripada molekul perencat. Inhibitor yang paling kompetitif terikat ke tapak aktif. Ini kerana perencat tidak mengubah bentuk tapak aktif.
Apakah perencatan yang tidak kompetitif?
Perencatan yang tidak kompetitif adalah sejenis perencatan enzim di mana perencat mengurangkan aktiviti enzim. Di sini, perencat boleh mengikat enzim walaupun substrat sudah terikat ke tapak aktif enzim itu. Oleh itu perencat tidak mengikat ke tapak aktif. Oleh itu, tidak ada persaingan antara substrat dan perencat; Oleh itu, perencatan ini dikenali sebagai perencatan yang tidak kompetitif. Kemudian, substrat dan perencat boleh didapati pada enzim pada masa yang sama.
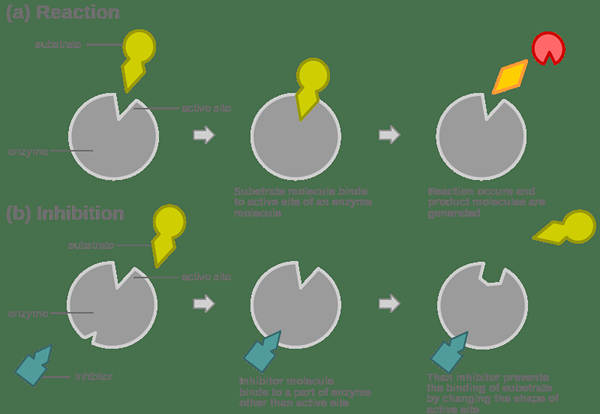
Rajah 2: Perencatan yang tidak kompetitif dalam rajah
Apabila perencat terikat pada enzim bersama dengan substrat, substrat tidak dapat menjalani tindak balas kimia yang dikehendaki untuk memberikan produk sasaran. Inhibitor yang tidak kompetitif sering mengikat enzim yang tidak dapat dipulihkan. Ini kerana pengikatan perencat mengubah bentuk tapak aktif dan tapak aktif mendapat dinyahaktifkan.
Bentuk perencat adalah sama sekali berbeza dengan substrat kerana perencat tidak bersaing untuk tapak aktif pada enzim. Inhibitor yang tidak kompetitif mengikat dengan tapak yang berhampiran dengan tapak aktif. Mengikat ini menyebabkan perubahan bentuk tapak aktif.
Apakah perbezaan antara perencatan yang kompetitif dan tidak kompetitif?
Perencatan yang kompetitif vs perencatan yang tidak kompetitif | |
| Perencatan yang kompetitif adalah sejenis perencatan enzim di mana perencat mengikat ke tapak aktif enzim, menghalang substrat dari mengikat ke enzim. | Perencatan yang tidak kompetitif adalah sejenis perencatan enzim di mana perencat mengurangkan aktiviti enzim. |
| Persaingan dengan substrat | |
| Inhibitor yang kompetitif bersaing dengan substrat untuk tapak aktif. | Inhibitor yang tidak kompetitif tidak bersaing dengan substrat untuk tapak aktif. |
| Bentuk perencat | |
| Inhibitor yang kompetitif mempunyai bentuk yang sama dengan substrat | Inhibitor yang tidak kompetitif mempunyai bentuk yang berbeza dari bentuk substrat. |
| Kejadian pada enzim | |
| Substrat dan perencat yang kompetitif tidak dapat dijumpai pada enzim pada masa yang sama. | Substrat dan perencat yang tidak kompetitif boleh didapati pada enzim pada masa yang sama. |
| Kaedah mengikat | |
| Pengikatan inhibitor kompetitif dengan tapak aktif boleh diterbalikkan. | Pengikatan inhibitor yang tidak kompetitif dengan tapak aktif tidak dapat dipulihkan. |
| Kesan pada bentuk tapak aktif | |
| Bentuk tapak aktif tidak berubah apabila perencat yang kompetitif mengikat ke tapak aktif. | Bentuk tapak aktif berubah apabila perencat terikat pada enzim. |
Ringkasan -Kompetitif vs perencatan yang tidak kompetitif
Perbezaan utama antara perencatan yang kompetitif dan perencatan yang tidak kompetitif adalah bahawa dalam perencatan yang kompetitif, pengikatan perencat menghalang pengikatan molekul sasaran dengan tapak aktif enzim sedangkan, dalam perencatan yang tidak kompetitif, perencat mengurangkan aktiviti enzim.
Rujukan:
1. "Perencatan yang kompetitif."Wikipedia, Yayasan Wikimedia, 3 Mar. 2018, boleh didapati di sini.
2. "Perencatan yang tidak kompetitif."Wikipedia, Yayasan Wikimedia, 25 Mac. 2018, boleh didapati di sini.
3. "Tapak Aktif."Wikipedia, Yayasan Wikimedia, 25 Mac. 2018, boleh didapati di sini.
Ihsan gambar:
1. "Perencatan Kompetitif" oleh yang ditulis oleh Jerry Crimson Mann, yang diubahsuai oleh Timvickers, Vectorized oleh FvasconCellos - Imej: Perencatan Kompetitif.PNG (Domain Awam) melalui Wikimedia Commons
2. "Perencatan Kompetitif Allosteric 3" oleh Srhat (Talk · Contribs) Fail: comp_inhib.SVG: SVG Versi: Srhat (Talk · Contribs) PNG Versi: Jerry Crimson Mann di En.Wikipedia - Fail: comp_inhib.SVG (Domain Awam) melalui Commons Wikimedia


